
题目列表(包括答案和解析)
5.下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的图象是
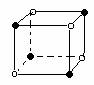
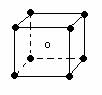
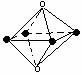
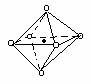
⑴ ⑵ ⑶ ⑷
A.图⑴和图⑶ B.图⑵和图⑶ C.只有图⑴ D.图⑴和图⑷
4.最近日本科学家确认世界上还存在的另一种“分子足球”N60,它与C60的结构相似.下列说法正确的是
A.N60是一种新型化合物 B.N60和14N都是氮的同位素
C.N60和N2是同素异形体 D.N60和N2是同系物
3.σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道或一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成.则下列分子中的σ键是由两个原子的s轨道以“头碰头”方式重叠构建而成的是
A.H2 B.HCl C.Cl2 D.F2
2.以下原子能产生发射光谱的是
A.1s22s1 B.1s22s22p1 C. 1s22s12p2 D. 1s22s22p3
1.(08年海南化学·22)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A.sp,范德华力 B.sp2,范德华力 C.sp2,氢键 D.sp3,氢键
原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
处于最低能量的原子叫做基态原子。
当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量。光(辐射)是电子释放能量的重要形式之一。
不同元素的原子发生跃迁时会吸收(基态→激发态)和放出(基态→激发态)能量,产生不同的光谱--原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。
典型高考试题例析
例1.(08年海南化学·23)在基态多电子原子中,关于核外电子能量的叙述错误的是
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
解析:选项C没有指明p轨道电子和s轨道电子是否处于同一电子层。答案:C。
10.(11分)(2007海南·25)A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
解析:(1)A元素原子核外共有5个电子,则核内为5个质子,因此为N。(2)B、C分别为17、19号元素即Cl、K。(3)D3+的电子排布式为1s22s22p63s23p63d5,可知D为26号元素,即Fe,因此其基态原子的电子排布式为1s22s22p63s23p63d64s2。(4)E元素原子核外共有29个电子,即第29号元素为Cu,电子排布式为1s22s22p63s23p63d104s1。
答案:(1)N(2)Cl K(3)Fe 1s22s22p63s23p63d64s2(4) Cu 1s22s22p63s23p63d104s1
例3.(09年福建理综·30)[化学--物质结构与性质](13分)
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
解析:本题考查物质结构与性质。29号为Cu。Y价电子:msnmpn中n只能取2,又为短周期,则Y可能为C或Si。R的核外L层为数,则可能为Li、B、N或F。Q、X的p轨道为2和4,则C(或Si)和O(或S)。因为五种元素原子序数依次递增。故可推出:Q为C,R为N,X为O,Y为Si。(1)Cu的价电子排布为3d104s1,失去两个电子,则为3d9。(2)Cu2+可以与NH3形成配合物,其中NH3中N提供孤对电子,Cu提供空轨道,而形成配位键。(3)Q、Y的氢化物分别为CH4和SiH4,由于C的非金属性强于Si,则稳定性CH4>SiH4。因为SiH4 的相对分子质量比CH4大,故分子间作用力大,沸点高。(4)C、N和Si中,C、Si位于同一主族,则上面的非金属性强,故第一电离能大,而N由于具有半充满状态,故第一电离能比相邻元素大,所以N>C>Si。(5)C、H形成的相对分子质量的物质为C2H2,结构式为H-C≡C-H,单键是σ键,叁键中有两个是σ键一个π键,所以σ键与π键数之比为3︰2。(6)电负性最大的非元素是O,最小的非金属元素是Si,两者构成的SiO2,属于原子晶体。
答案:(1)1s22s22p63s23p63d9 (2)孤对电子(孤电子对)(3)b (4)Si < C <N (5) 3:2 (6)原子晶体
专题训练
4.洪特规则:电子排布在同一能级的各个轨道时,优先占据不同的轨道,且自旋方向相同。
3.泡利原理:每个原子轨道里最多只能容纳2个自旋方向相反的电子。
2.能量最低原理:原子核外电子遵循构造原理排布时,原子的能量处于最低状态。即在基态原子里,电子优先排布在能量最低的能级里,然后排布在能量逐渐升高的能级里。
1.构造原理:绝大多数基态原子核外电子的排布都遵循下列顺序:
1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f……
构造原理揭示了原子核外电子的能级分布。从中可以看出,不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
构造原理是书写基态原子电子排布式的依据,也是绘制基态原子电子排布图(即轨道表示式)的主要依据之一。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com