
题目列表(包括答案和解析)
2.已知4NH3+5O2=4NO+6H2O,正确的关系是 ( )
A.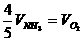 B.
B.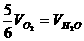
C.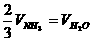 D.
D.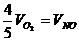
1.在2L的密闭容器中发生下面反应:A(g)+2B(g)=3C(g),经过3min后A的物质由10mol
变为7mol,则下面表示的反应速率正确的是 ( )
A.vA=1mol·L-1·min-1 B.vB=1mol·L-1·min-1
C.vC=2mol·L-1·min-1 D.vB=2mol·L-1·min-1
6、甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)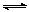 HCOOH(l)+CH3OH(l);△H>0
HCOOH(l)+CH3OH(l);△H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
|
组分 |
HCOOCH3 |
H2O |
HCOOH |
CH3OH |
|
物质的量/mol |
1.00 |
1.99 |
0.01 |
0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
|
反应时间范围/min |
0~5 |
10~15 |
20~25 |
30~35 |
40~45 |
50~55 |
75~80 |
|
平均反应速率/(10-3mol·min-1) |
1.9 |
7.4 |
7.8 |
4.4 |
1.6 |
0.8 |
0.0 |
请计算15-20min范围内甲酸甲酯的减少量为 mol,
甲酸甲酯的平均反应速率为 mol·min-1。
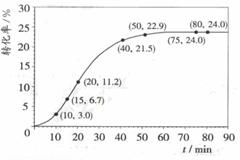 (2)依据以上数据,写出该反应的反应速率在不同
(2)依据以上数据,写出该反应的反应速率在不同
阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为:
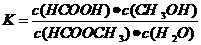 ,
,
则该反应在温度T1下的K值为 。
5、 在一定体积的密闭容器中,进行如下化学反应:A(g) +
3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:A(g) +
3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
|
t/K |
298 |
398 |
498 |
… |
|
K/(mol·L-1)-2 |
4.1×106 |
8.2×107 |
K1 |
… |
请完成下列问题:
该反应的化学平衡常数表达式为K= 。
判断该反应的ΔH 0(填“>”或“<”)
在一定条件下,不能判断该反应已达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.D的物质的量不变
C.容器内压强保持不变 D.混合气体的密度保持不变
4、高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) Fe(s)+CO2(g) -Q ,其平衡常数可表达为 K=
Fe(s)+CO2(g) -Q ,其平衡常数可表达为 K=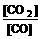 ,已知1100℃时,K=0.263 。
,已知1100℃时,K=0.263 。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO和体积比值
平衡常数K值 (本小题空格均备选:增大、减小或不变)
(2)1100℃时测得高炉中[CO2]=0.025mol/L [CO]=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (选填是或否),此时,化学反应速度是V正 V逆(选填大于、小于或等于),其原因是
3、在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
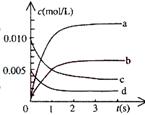 (1)写出该反应的平衡常数表达式:K=__
__。
(1)写出该反应的平衡常数表达式:K=__
__。
已知:K(300℃)>K(350℃),该反应是________热反应。
(2)右图中表示NO2的变化的曲线是________。用O2表示从
0-2s内该反应的平均速率v=_________。
(3)能说明该反应已经达到平衡状态的是______。
a、v(NO2)=2v(O2) ;b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度c、增大O2的浓度 d、选择高效的催化剂
2、PCl5的热分解反应如下:PCl5(g)
 PCl3(g)+ Cl2(g)
PCl3(g)+ Cl2(g)
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测
得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数。
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
1.黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:
 2SO2(g) + O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO2(g) + O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下
列措施中有利于提高SO2平衡转化率的有 (填字母)
A、升高温度 B、降低温度 C、增大压强(压缩)
D、减小压强 E、加入催化剂 G、移出氧气
19.(08年山东理综·29)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)
== CH4(g)+HC
 CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH3CH
 CH2(g) ==
CH4(g)+HC
CH2(g) ==
CH4(g)+HC
 CH(g
) △H2=32.4 kJ·mol-1
CH(g
) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH
 CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是
(用离子方程式和必要的文字说明)。
18.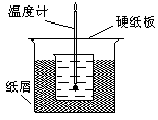 50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在右图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题。
50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在右图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题。
(1)大小烧杯间填满碎纸条的作用是什么?
(2)大烧杯上如不盖硬纸板,对求得中和热的数值有何影响?
(3)改用60 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量是否相等?所求中和热数值是否相等?简述理由
(4)用相同浓度和体积的氨水代替氢氧化钠溶液进行上述实验,为什么测得中和热的数值偏低?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com