
题目列表(包括答案和解析)
6.25℃时某溶液中由水电离出的c(OH-)为1×10-11mol/L,则该溶液的PH可能等于( )
①11 ②8 ③7 ④3
A.①④ B.①② C.①③ D.②③
5.下列物质在水溶液中,存在电离平衡的是 ( )
A.NaOH B.CH3COOH C.BaSO4 D.CH3COONa
4.区分强电解质和弱电解质的依据是 ( )
A.溶解度的大小 B.属于离子化合物还是共价化合物
C.是否存在电离平衡 D.导电性的强弱
3.在2A+B 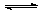 3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的
3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的
是 ( )
A.vA=0.5mol·L-1·min-1 B.vB=0.3mol·L-1·min-1
C.vC=0.8mol·L-1·min-1 D.vD=1mol·L-1·min-1
2.已知4NH3+5O2=4NO+6H2O,正确的关系是 ( )
A.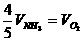 B.
B.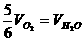
C.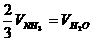 D.
D.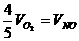
1.在2L的密闭容器中发生下面反应:A(g)+2B(g)=3C(g),经过3min后A的物质由10mol
变为7mol,则下面表示的反应速率正确的是 ( )
A.vA=1mol·L-1·min-1 B.vB=1mol·L-1·min-1
C.vC=2mol·L-1·min-1 D.vB=2mol·L-1·min-1
2.(5分)有平均相对分子质量为8.5的氮、氢混合气体,通过合成塔出来的混合气体平均分子质量为9.44,求氮气的转化率。
1.(6分)若设混合后的溶液体积为原混合液体积之和,计算下列混合液的PH。
(1)pH=3和pH=6的盐酸溶液等体积混合
(2)pH=12的NaOH溶液和pH=9的Ba(OH)2溶液等体积混合。
4.(8分)在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
①生成SO3 mol;
②O2的转化率为 ;
③平衡时容器内气体总物质的量为 mol;
④平衡时体系中SO3的百 分含量(体积分数)为 ;
⑤平衡时s(SO2)= mol/L;c(O2)= mol/L; c(SO3)= mol/L;
⑥若反应前容器内压强为p1,则平衡时容器内的压强为 (用p1表示)
3.(4分)在100℃和200kPa的条件下,反应aA(g) 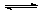 bB(g)+c
C(g)建立平衡后,在不
bB(g)+c
C(g)建立平衡后,在不
加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反
应建立平衡时物质B的浓度。
|
压强(kPa) |
200 |
500 |
1000 |
|
B的浓度(mol/L) |
0.04 |
0.1 |
0.27 |
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡 转移(填“正向”或“逆向”或“不”),理由是 。
(2)压强从500kPa增加到1000kPa时,平衡 方向转移(填“正向”或“逆向”或“不”),其原因可能为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com