
题目列表(包括答案和解析)
26.(105分)在众多的化学反应现象中,化学振荡现象最为令人惊奇,化学振荡实验很多,其中酸与铁丝的反应就是其中一例。某合作小组的同学查阅文献资料后,拟做铁丝与酸的化学振荡实验并进行探究。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油 污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol/L的H3PO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现 象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是________ (填序号)。
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是___________________________________。
乙同学认为是O2,其可能的理由是___________________________________。
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中 氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是_____________________。
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
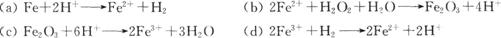
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为____________________________。
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量 浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
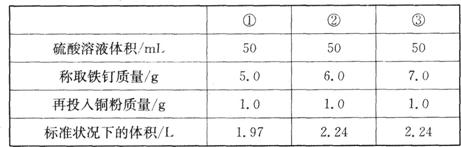
所配硫酸的物质的量浓度为__________mol/L;铁钉中单质铁的质量分数为_________。
25.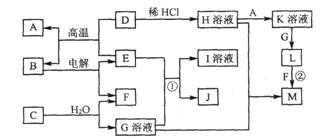 (6分)以下框图中A→M是中学化学中常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。
(6分)以下框图中A→M是中学化学中常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。
请回答下列问题:
(1)E在元素周期表中的位置___________; C物质中所包含的化学键类型____________。
(2)写出反应①的离子方程式:_________________________________。
(3)写出反应②的化学方程式:_________________________________。
24.(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做l题。若两题都作答,则以A题计分。
A.《化学与生活》
(1)(6分)2010年上海世博会主题是“城市,让生活更美好”,试回答下列问题:
①为确保世博会期间申城空气质量优良率达到95 %以上,世博会期间的空气质量状况监测中,不需要监测的指标是_____________。
A.可吸入颗粒物(PM10) B.NO2浓度
C.SO2浓度 D.CO2浓度
②造成臭氧层空洞的主要物质是___________________。
③为2010年世博会期间提供科学有效的环境质量保障方案,白龙港污水处理厂升级改造,处理废水时加入K2SO4·A12(SO4)3·24H2O或碱式氯化铝的作用是_______________;通入臭氧或二氧化氯的作用是______________________________。
④绿色上海世博,亮点之一是二氧化碳零排放。为了适应低碳生活,参观世博园最好是_______________ (A.驾私家车 B.乘公交车);世博停车场,安装有汽车尾气催化光解设施。写出汽车尾气中CO、NO相互作用生成可参与大气循环的两种气体的化学方程式_______________。
(2)(5分)随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的有关问题:
①发育出现障碍,患营养缺乏症,如某地曾经出现过的“大头娃娃”,这主要是由于摄取_________(填“蛋白质”、“脂肪”或“维生素”)不足引起的。
②微量元素与人体健康密切相关,若膳食结构不合理,摄入某种微量元素不足,就会引起某些疾病,例如身材矮小,腰背弯曲可能是由于缺________,人体铁元素摄入量不足可能会导致_________。
③维生素是参与生物生长发育和新陈代谢所必需的一类小分子有机化合物;我们所熟悉的维
生素有A、B、C、D、E等。其中维生素C又称 ,如果人体缺少
易患夜盲症。
(3)(4分) 糖类、油脂和蛋白质是人体需要的重要营养素。
①a.大米 b.青菜c.猪肉这三种物质中,富含淀粉的是 ,属于碱性食物的是 。(填字母)
②a.葡萄糖b.油脂c.纤维素d.蛋白质这四种物质中,属于天然高分子化合物的是 ,在一定条件下能水解的是 。(填字母)
B.《有机化学基础》
(1)(3分)今有下列有机物:

①互为同分异构体的是_______________。
②互为同系物的是_______________。
 ③核磁共振氢谱只有一个峰的是_______________。
③核磁共振氢谱只有一个峰的是_______________。
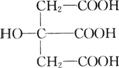
(2)(6分)柠檬酸结构简式为
①柠檬酸中的官能团有____________。
②1 mol柠檬酸最多可消耗NaOH的物质的量为_______________mol。
③柠檬酸可以发生的反应为_______________。
a.酯化反应 b.加成反应 c.氧化反应 d.消去反应
(3)(6分)溴系阻燃剂是目前世界上产量最大的有机阻燃剂,八溴醚是以苯酚为原料合成 的,合成路线如下:
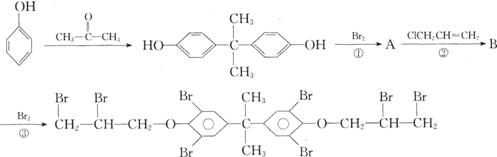
反应①、③消耗Br2的物质的量之比为_______________;物质B的结构简式为_____________。
23.有某硫酸铜、硫酸亚铁、硫酸铁的混合溶液100mL,已知溶液中各种阳离子的物质的量相等,硫酸根离子的浓度为7mol /L。此溶液最多能溶解铁粉的质量为
A.10.6g B.11.2g C.16.8g D.5.6g
22.某无色溶液中只可能含有Na+、K+、Fe3+、Cu2+、SO42-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液呈碱性;②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。③另取少量原溶液,向溶液中滴加足量氯水,再加入CCl4振荡,静置后CCl4层呈橙红色。④用分液漏斗分液,取上层溶液,加入Ag NO3和HNO3的混合溶液有白色沉淀产生。⑤用洁净的铂丝蘸取少量原溶液灼烧,火焰呈黄色。则关于原溶液的判断中不正确的是
A.肯定不存在的离子是Fe3+、Cu2+、SO42-
B.肯定存在的离子是Na+、Br-、CO32-
C.无法确定原溶液中是否存在Cl-、CO32-
D.若要确定原溶液中是否存在K+,则步骤⑤中还需再透过蓝色的钴玻璃片观察火焰颜色
21.下列现象或事实能用同一原理解释的是
A.乙烯能使Br2水和KMnO4溶液褪色
B.二氧化硫、氯气都会使品红溶液褪色
C.饱和(NH4) 2SO4溶液和饱和CuSO4溶液都能使蛋白质溶液产生沉淀
D.常温下,铁片和铝片放入浓硫酸中都能出现钝化现象
20.下列各组顺序的排列不正确的是
A.原子半径:Na<Mg<Al
B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2SiO3<H2CO3<HNO3
D.碱性强弱:KOH>NaOH>Mg(OH)2
19.下列反应不属于取代反应的是
A.苯与液溴反应 B.乙醇与乙酸酯化
C.乙烯与氢气反应 D.甲烷与氯气光照反应
18.在一定温度下,向2 L某恒容密闭容器中加入1mol X气体和2mol
Y气体,发生如下反应:X(g)+2Y(g) 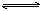 2Z(g),5min时测得Z的物质的量为1.2mol,下列说法正确的是
2Z(g),5min时测得Z的物质的量为1.2mol,下列说法正确的是
A.此时Y的浓度为0.6mol/L
B.5min 内v (X)=0.06mol/(L·min)
C.容器内X、Y、Z的浓度之比为1:2:2,则该反应达到平衡状态
D.单位时间消耗0.1 molX同时生成0.2molZ,则该反应达到平衡状态
17.1820年德贝莱纳用MnO2催化KClO3分解制氧,发现制得氧气有异常的气味,使该气体通入KI淀粉溶液,溶液变蓝。则该氧气中可能混有
A.Cl2 B.Br2 C.HCl D.CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com