
题目列表(包括答案和解析)
7.下列措施,一定不能加快化学反应速率的是……………………………………( )
A.有气体参加反应时增大压强 B.升高反应混合物的温度
C.加入合适的催化剂 D.其他量均不变仅增大容器体积
6.下列各组物质混合后, 不能得到A1(NO3)3的是…………………………………( )
A.氧化铝和硝酸 B.铝和稀硝酸共热 C.铝和硝酸汞溶液 D.铝和冷浓硝酸
5.一元强酸和一元强碱恰好完全中和时,它们一定相等的是…………………( )
A.体积 B.质量 C.物质的量浓度 D.H+和OH– 的物质的量
4.随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是……………………………………………………………………………( )
A.利用电池外壳的金属材料
B.回收其中石墨电极
C.防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D.不使电池中泄漏的电解液腐蚀其他物品
3.下列物质中,没有固定沸点的是………………………………………………( )
A.正已烷 B.苯 C.汽油 D.乙烯
2.人类未来理想的燃料是…………………………………………………………( )
A.煤 B.石油 C.天然气 D.氢气
1.影响化学反应速率的最主要因素是………………………………………………( )
A.反应物的化学性质 B.催化剂 C.反应物的浓度 D.反应温度
23.(16分)Ⅰ.下列实验操作或实验叙述正确的是______________ (填序号)
①使用50mL酸式滴定管准确量取18.00 mL KMnO4溶液; ②用10 mL量筒量取5.80 mL盐酸; ③用稀醋酸除去热水瓶内的水垢[主要成分Mg(OH)2和CaCO3等];
④用蒸馏水润湿的pH试纸测定溶液的pH一定有误差;
⑤配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
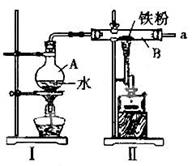 Ⅱ.某探究小组的同学设计实验探究铁与水蒸气的反应,并探究反应后生成物的一系列性质。
Ⅱ.某探究小组的同学设计实验探究铁与水蒸气的反应,并探究反应后生成物的一系列性质。
(1)右图为铁与水蒸气反应的实验装置,实验前应先检验装置的气密性,简述其检验的方法_______________ 。
(2)写出图II中硬质玻璃管B内所发生反应的化学方程式______________________________________________。
(3)若要证明硬质玻璃管B中反应后的气体产物是H2,还需从下图中选择必要的仪器和药品,设计出一套装置,其连接顺序为:a连____,____连____,____连____。(填接口字母)
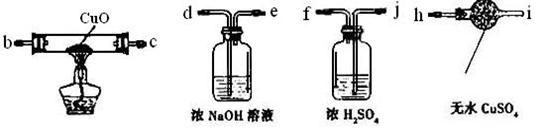
(4)反应后,将图II装置中硬质玻璃管B内的全部固体置于试管中,加入60 mL 1mol/L的稀盐酸,固体恰好完全溶解,再滴加KSCN溶液,发现溶液不显血红色,写出此过程中所有可能发生反应的离子方程式_________________________________________________________________________ _
反应前硬质玻璃管B中加入Fe粉的质量为__________g。
命题:陈军、郭丽
2010年重庆一中高2011级期末考试
22.(8分)在一定条件下发生反应 :2
SO2(g) + O2(g)  2 SO3(g);
2 SO3(g);
(1)500℃时,将a mol SO2与b mol O2以3︰2通入固定容积为5L的密闭容器中。
①反应进行至10 min时,测得n(SO2) = 8 mol ,n(SO3) = 4 mol,则b= mol.
②反应达到平衡后,测得容器内压强是反应起始压强的0.715倍,则平衡时
c(SO3)= mol/L,SO2的转化率为 。
(2)当反应温度、起始SO2与O2物质的量及开始时容器容积均与(1)中相同时,将其混合气体通入一恒压反应容器中,达到平衡时SO2转化率 (1)中SO2的转化率(填“=”、“>”或“<”).
21.(10分)铁、铜、铝是生活中使用广泛的金属:
(1)FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为
,若将此反应设计成原电池,则负极所用电极材料为 ,正极反应式为 。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池:
①在这两个原电池中,负极分别为
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
②写出插入烧碱溶液中形成原电池的负极反应式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com