
题目列表(包括答案和解析)
1.对Na、Mg、Al的有关性质的叙述不正确的是
A.第一电离能:Na< Mg <Al B.电负性:Na< Mg< Al
C.还原性:Na> Mg >Al D.碱性:NaOH> Mg(OH)2> Al(OH)3
命题人:李祥赫 审校人:刘晓妮
说明:1.测试时间:90分钟 总分:100分
2.客观题涂在答题卡上,主观题答在答题纸上
第Ⅰ卷 (选择题,共50分)
29、(5分)计算:
在100mL 2mol/L的Ba(OH)2溶液中滴加100mL NaHSO4溶液,测得溶液的pH为1,求产生的沉淀的质量以及NaHSO4溶液的物质的量浓度。
28、(6分)
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)__ __。
A.9 B.13 C.11-13之间 D.9-11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)__ ___。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),①__ _和_ __两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。
27、 (6分)甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
(6分)甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象
乙:① 用pH计测定物质的量浓度均为0.1 mol·L-1 HA和HCl溶液的pH;
② 再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/20 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH 1(填“>”、“<”或“=”) ;
(2)乙同学设计的实验第______步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小, c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入_________试剂(选填“A”“B”“C”“D”,下同);②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入_____试剂。
A. NaA固体(可完全溶于水) B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4 D.2 mol·L-1 HA
(3) pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有
 A.两种酸溶液的物质的量浓度一定相等
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
26、(10分)(1)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-9 mol/L,在此温度下pH均为4的盐酸和(NH4)2SO4溶液中由水电离出的c(H+)之比为__________。
(2)将标准状况下的4.48 L氨气完全溶解在含0.1 mol HCl的水溶液中形成1 L溶液,所得溶液pH=10,其中离子浓度由大到小的顺序是 ;
无论氨水与盐酸以何种比例混合,溶液中始终存在的等量关系是c(NH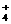 )+c(H+)= 。
)+c(H+)= 。
(3)常温下,pH=10的强碱AOH和pH=4的酸HnB等体积混合后溶液显酸性,生成的盐化学式为_______________。AOH与HnB完全中和所得溶液呈______性,其原因用离子方程式表示为____________ _ _____________。
25、(7分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
 ② 固定好滴定管并使滴定管尖嘴充满液体
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。 请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(4)图是某次滴定时的滴定管中的液面,其读数为 mL
(5)根据下列数据:请计算待测盐酸溶液的浓度: mol/L
|
滴定次数 |
待测液体积(mL) |
标准烧碱体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.40 |
20.40 |
|
第二次 |
20.00 |
4.00 |
24.00 |
|
第二次 |
20.00 |
2.00 |
24.10 |
24、(6分)(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”或“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-);(填“ >”或“=”或“<”,下同)。
(2)室温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-) ;
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(CH3COO-)和c(Na+)相等,则混合后液呈 ,醋酸体积 氢氧化钠溶液体积。
23、(4分)(1)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):_____________________ ________ ,
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (写化学式);
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
22、室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加水稀释2倍后,两溶液的pH均减小
B. 使温度都升高20℃后,两溶液的pH均不变
C. 加适量的醋酸钠晶体后,两溶液的pH均增大
D.加足量的锌充分反应后,醋酸产生的氢气与盐酸产生的氢气一样多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com