
题目列表(包括答案和解析)
21.正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3,分子之间通过氢键相连(层状结构如下图所示,图中“虚线”表示氢键)。下列有关说法正确的是:
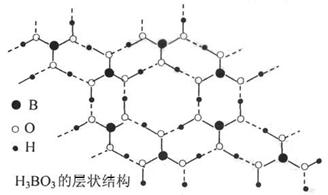
A.含1 molH3BO3的晶体中有6 mol氢键。
B.分子中硼原子、氧原子最外层均为8 e一的稳定结构。
C.正硼酸晶体属于原子晶体。
D.H3BO3分子的稳定性与氢键无关。
20.在25℃时将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,下列关系式正确的:
A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) B.c(H+)= c(CH3COO-)+ c(OH-)
C.c(Na+)= c(CH3COO-)+c(CH3COOH) D.c(Na+)>c(CH3COO-)> c(OH-)> c(H+)
19. F2和Xe在一定条件下可生成XeF2、 XeF4和 XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解。其中6XeF4 +12H2O==2XeO3+4Xe↑+24HF+3O2↑,下列推测正确的是
F2和Xe在一定条件下可生成XeF2、 XeF4和 XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解。其中6XeF4 +12H2O==2XeO3+4Xe↑+24HF+3O2↑,下列推测正确的是
A.XeF2分子中各原子均达到八电子的稳定结构
B.某种氟化氙的晶体结构单元如右图所示,可推知其化学式为XeF6
C. XeF4按已知方式水解,每生成4mol Xe转移16mol电子
D. XeF2加入水中,在水分子的作用下,将重新生成Xe和F2
18.下列说法正确的是
A.冰、水和水蒸气中都存在氢键
B.除稀有气体外的非金属元素都能生成不同价态的含氧酸
C.干冰升华时分子内共价键会发生断裂
D.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+11
17.下表是五种银盐的溶度积常数(25℃):
|
化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
|
溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
下列说法错误的是:
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
16.解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是
①HF、HCl 、HBr、HI的热稳定性依次减弱 ②NH3易液化
③F2、C12、Br2、I2的熔、沸点逐渐升高 ④H2S的熔沸点小于H2O的熔、沸点
⑤NaF、NaCl、NaBr、NaI的熔点依次减低
A.①③④ B.②③④ C.③④ D.全部
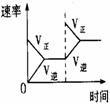
15.对于可逆反应N2(g)+3H2(g) 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
|
|
A |
B |
C |
D |
|
研究目的 |
压强对反应的影响(P2>P1) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的影响 |
|
图示 |
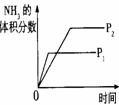 |
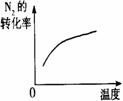 |
 |
 |
14.燃料电池(如CO,CH4,CH3OH等与O2组成),用惰性电极插入KOH溶液中,在两极分别通入CH3OH和O2,有关此电池判断正确的是:
A.正极反应式:2CH3OH+2H2O-12e-→2CO2↑+12H+
B.放电一段时间后,负极的PH值升高
C.放电一段时间,阳离子向负极移动,阴离子向正极移动
D.该电池在工作时,每消耗32gCH3OH,外电路中通过6mole-
13.萤石(CaF2)是一种难溶于水的固体。下列实验事实能说明CaF2一定是离子晶体的是
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔点较高,硬度较大
C.CaF2固体不导电,但在融化状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
12.用惰性电极电解100mL4mol ·L-1的CuSO4溶液,一定时间后在阳极收集到1.12 L气体,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+浓度为(设溶液的体积不变,反应前后均为标准状况)
A、2.7 mol· L-1 B、3 mol· L-1 C、4 mol· L-1 D、1 mol· L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com