
题目列表(包括答案和解析)
24、(8分)计算题:化学反应2SO2(g)+O2  2SO3(g)是硫酸制造工业的基本反应,将0.050molSO2(g)和0.04molO2(g)注入体积为1L的密闭反应器中,并置于750K的恒温环境下,达到平衡后,测得反应器中有0.04molSO3(g),
2SO3(g)是硫酸制造工业的基本反应,将0.050molSO2(g)和0.04molO2(g)注入体积为1L的密闭反应器中,并置于750K的恒温环境下,达到平衡后,测得反应器中有0.04molSO3(g),
求①750K时该反应的平衡常数
②O2的平衡转化率
③SO3的平衡产率
23、(12分)运用化学反应原理处理下列问题
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),
2NH3(g),
若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动
(填“向左”、“向右”或“不”);
若在恒温、恒容条件下向平衡体系中通入氩气,平衡 移动
(填“向左”、“向右”或“不”)
使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
(2)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),
生成该沉淀的离子方程式为 。
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl- )。则溶液显 性(填“酸”、“碱”或“中”);
22、(9分)从H+、Na+、Ba2+、Cu2+、Cl-、SO42-中选出两种离子组成电解质,按下列要求进行电解,将电解质的化学式填空:(使用惰性电极)
(1) 电解过程中溶液颜色变浅但水量不变_______________________;
(2) 电解过程中电解质含量不变,水量减少_______________________;
(3) 电解过程中溶液的pH值增大_______________________;
(4) 电解过程中,两极析出气体的体积比为1∶1__________。
21、(7分)分别写出下列水溶液中存在的带电微粒和可能发生反应的
离子方程式没有反应的空着,并判断溶液的酸碱性。
微粒 离子方程式 酸碱性
(1)CH3COONa溶液: , ,
(2)NH4Cl 溶液: , ,
(3)KNO3 溶液 , ,
20、(8分)在0.1mol/l的氨水中存在如下电离平衡: NH3
·H2O  NH4+ +OH-,改变下列条件,填写下表中的变化情况。
NH4+ +OH-,改变下列条件,填写下表中的变化情况。
|
变化条件 |
一水合氨的电离平衡如何移动 |
导电能力 |
Kb |
溶液pH |
|
升高温度 |
|
|
|
|
|
加入少量NaOH固体 |
|
|
|
|
|
通入少量氯化氢气体 |
|
|
|
|
|
加入少量CH3COONH4固体 |
|
|
|
|
19、(2分)已知:Fe2O3(s)+C(s)= CO2(g)+2Fe(s) △H=234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
则2Fe(s)+O2(g)=Fe2O3(s)的△H是
18、已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
高二化学(科学)第Ⅱ卷(笔答题)
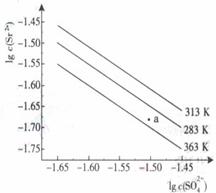
17、硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
A、温度一定时,Ksp(SrSO4)随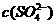 的增大而减小
的增大而减小
B、三个不同温度中,313K时Ksp(SrSO4)最大
C、283K时,图中a点对应的溶液是饱和溶液
D、283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
16、反应2A(g)+B(g) 2C(g) △H>0。下列反应条件有利于生成C的是:
2C(g) △H>0。下列反应条件有利于生成C的是:
A、低温、低压 B、低温、高压 C、高温、高压 D、高温、低压
15、下列离子方程式正确的是:
A.向盐酸中滴加氨水:H++OH-=H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.Na2S2O3溶液中通入足量氯气:
S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com