
题目列表(包括答案和解析)
2.下列说法不正确的是
A、焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行
B、自发进行的反应一定能迅速进行
C、在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
D、一个反应能否自发进行,与焓变和熵变的共同影响有关
1.下列对化学反应的认识错误的是
A.会引起化学键的变化 B.会产生新的物质
C.必然引起物质状态的变化 D.必然伴随着能量的变化
29、(共4分)0.25 20% (每个2分)
29、(4分)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后测得c(H2)=0.008mol/L。求:(1)该反应的平衡常数。 (2)在同样的温度下,该容器中若通入H2和I2(g)各0.20mol,试求达到平衡状态时H2的转化率。
平湖中学2009-2010学年第二学期高二月考答案
⑵ ①增加压强 (1分) t2-t3
(1分) ② 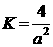 (2分)
(2分)
③ < (1分) 该反应是可逆反应,1mol N2和3molH2不能完全化合生成2molNH3,所以反应放出的热量小于92.4kJ。(3分)
28、(10分)氢气是一种新型的绿色能源,又是一种重要的化工原料。 [
(1)氢气燃烧热值高,实验测得在常温常压下,1gH2完全燃烧生成液态水,放出142 . 9 kJ 热量。则表示H2燃烧的热化学方程式为:
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
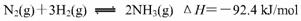
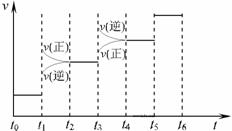
① 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
 [
[
图中t1 时引起平衡移动的条件可能是
其中表示平衡混合物中NH3的含量最高的一段时间是 [
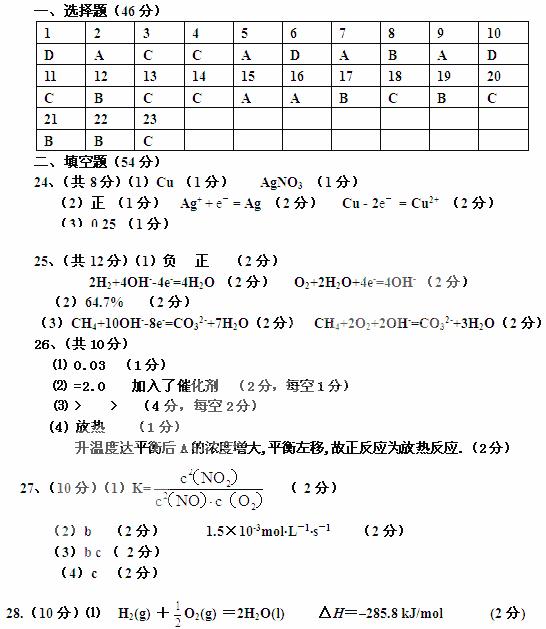
②温度为T℃时,将2amolH2和amolN2放入0 .5L密闭容器中,充分反应后测得N2的转化率为50﹪。则反应的平衡常数为 [
③ 在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是________ _________.[
27、(10分)在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
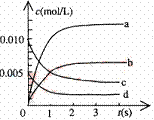 (2)右图中表示NO2浓度的变化的曲线是
。
(2)右图中表示NO2浓度的变化的曲线是
。
用O2表示从0~2s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
26、(10分)某化学反应 3 A  2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
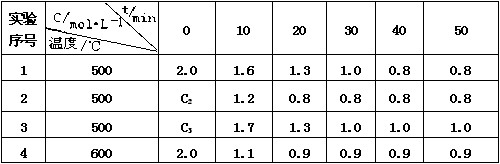
根据上述数据,完成下列填空:
(1)在实验 1 ,反应在10 min -20 min 内平均速率为_______ mol /(L·min)
(2)在实验 2 ,A 的初始浓度 C2 _______ mol / L,反应经 20 min 就达到平衡,可推测实验 2 中还隐含的条件是____________________________
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3 ____v1 (填 <、>或=),且C3 ______ 2.0 mol / L (填 <、>或=)
(4)比较实验 4 和实验 1,可推测正反应是______反应(填吸热或放热)。理由是 _____
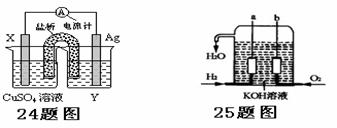
25、(12分)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)a极是____极,b极是____极,电极反应式分别为_______________,_____________。
(2)飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电时能生成350g水,此时能量转化率为___________。[2H2(g)+O2(g) =2H2O(l) △H=-572kJ/mol]
(3)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式为____________________________。此时电池内总的反应方程式为_________________________________________________。
24、(8分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的____极,发生的电极反应___ ___;X电极上发生的电极反应为 [来
(3)当Ag+的消耗速率为0.05mol/(L·min )时,Cu2+的生成速率为: mol/(L·min )
23、 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2 + 2Ni(OH)2
Cd + 2NiO(OH) + 2H2O,由此可知,该电池放电时的负极材料是
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2 + 2Ni(OH)2
Cd + 2NiO(OH) + 2H2O,由此可知,该电池放电时的负极材料是
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com