
题目列表(包括答案和解析)
1.下列几组量子数能够同时存在的是 ( )
A. 3,0,0,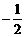 B.
3,3,0,
B.
3,3,0,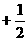
C. 4,3,1,1
D. 3,0,1,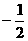
相对原子质量: H-1 C-12 N-14 O-16 S-32 Si-28 Cu-64 Cl-35.5 P-31
37.(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应: ;
银片上发生的电极反应: 。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:
①产生氢气的体积(标准状况) ____________________。
②通过导线的电量____________________________。
(已知NA=6.02×1023/mol,电子电荷为1.60×10-19C)
金华八中09学年度第二学期第一次阶段考
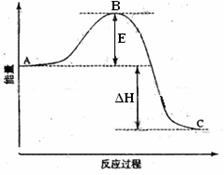
35(12分)2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= -99kJ·mol-1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= -99kJ·mol-1.请回答下列问题:
(1)图中A点表示 。E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式
, 。
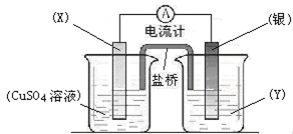 36(共7分)依据氧化还原反应:
36(共7分)依据氧化还原反应:
2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极(填电极材料名称)。
34.H2(g)+ I2(g)  2HI(g)已经达到平衡状态的标志
。
2HI(g)已经达到平衡状态的标志
。
①c(H2)=c(I2)=c(HI)时 ②c(H2):c(I2):c(HI)=1:1:2时
③c(H2)、c(I2)、c(HI)不再随时间而改变 ④单位时间内生成nmolH2的同时生成2nmolHI
⑤单位时间内生成n mol H2的同时生成n mol I2 ⑥反应速率v(H2)=v(I2)=1/2v(HI)
⑦一个H-H键断裂的同时有两个H-I键断裂
 ⑧温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,容器内压强不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
⑾条件一定,混合气体的平均相对分子质量不再变化
(共4分,多选,错选倒扣分,扣完为止)
33.(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1mol NH3时可放出46.2kJ的热量。
N-H键的键能是 。
(2)发射卫星用N2H4气体为燃料,NO2气体为氧化剂,两者反应生成N2和水蒸气,已知:
N2 (g)+2O2 (g) = 2NO2 (g) △H1=+67.7 kJ·mol-1;
N2H4 (g)+O2 (g) = N2 (g)+2H2O(g) △H2=-534 kJ·mol-1;
H2O(L) = H2O(g) △H3=+44.0 kJ·mol-1。
写出N2H4气体与NO2气体反应生成氮气和液态水的热化学方程式 :
__________________________________________________________________
32.用离子方程式表示下列化学变化:
(1)电解氯化钠溶液____________________________________________
(2)电解硝酸银溶液____________________________________________
31.在密闭容器中进行可逆反应,A与B反应生成C,其反应速率可分别用v(A)、v(B)、v(C)表示,且有如下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应的化学方程式为: .
30.用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为
A.1 mol·L-1 B.2 mol·L-1 C.3 mol·L-1 D.4 mol·L-1
Ⅱ卷
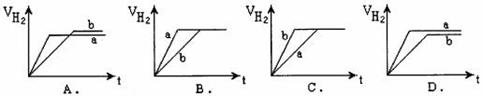
29.等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,b保持不变,下列各图是产生H2的体积V(L)与时间t(min)的关系,其中正确的是
 ]
]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com