
题目列表(包括答案和解析)
21.(10分)(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
 (2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极反应为
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极反应为
。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与右图中
电解池相连,其中,a为电解液,X和
Y是两块电极板,则:
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为 。
通过一段时间后,向所得溶液中加入0.3molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为 。
20.(10分)
(1)现有0.1mol·L-1的纯碱溶液,其溶液呈 性,原因是(用离子方程表示)
。
(2)欲使0.1mol·L-1Na2CO3溶液中c(Na+)=2 c(CO32-),应采取的措施是 。
A.加少量盐酸 B.加适量的KOH C.加适量的水 D.加适量的NaOH
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是 。
A.甲同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B.乙同学:在稀盐酸中加入稀氨水,混合液温度上升,说明盐类水解是吸热的。
C.丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D.丁同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。
(4)为探究纯碱溶液呈碱性是由CO32-引起的,请你用纯碱溶液、酚酞、氯化钙溶液做试剂设计一个简单的实验方案
。
(5)有资料记载:常温下,0.1mol·L-1的纯碱溶液,发生水解的CO32-离子不超过其总量的1%。请你用pH试纸设计实验验证之 。
19. (13分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低_____________________________________________、理由是__________________________。
18. 甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是 ( )
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第二周期IVA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
17.下列说法正确的是 ( )
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素间不能形成共价键
C.水分子可表示为HO-H,分子中键角为180°
D.H-O键键能为463KJ∕mol,即18gH2O分解成H2和O2时,消耗能量为2×463KJ
16.pH=2的两酸HA、HB加水稀释后,溶液pH随加水量的变化曲线如右图所示。则下列叙述正确的是 ( )
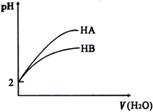 A.电离平衡常数HA<HB
A.电离平衡常数HA<HB
B.等体积的HA和HB与等浓度的NaOH反应,HB消耗的NaOH多
C.等体积的HA和HB与等质量的Zn反应,HA平均反应速率大(设HA和HB足量)
D.若有等浓度的NaA、NaB,则碱性NaA>NaB
15.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是 ( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变。
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+。
C.硫酸铜水溶液里加入氨水生成的沉淀是氢氧化铜,继续加氨水沉淀又溶解,说明氢氧化铜是两性氢氧化物。
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道。
14.在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是( )
A.Li,F B.Na,F C.Na,C1 D.Mg,O
13.25 ℃时,水的电离达到平衡:H2O H++OH-;DH>0,下列叙述正确的是( )
H++OH-;DH>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水中加入少量固体NH4Cl,平衡正向移动,c(H+)降低
12.将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-) 正确的是 ( )
A.①⑤ B.③④ C.②⑤ D.②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com