
题目列表(包括答案和解析)
20. 以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极上析出铜的质量是 ( )
A.8g B.16g C.32g D.64g
19.按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
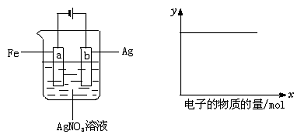
(1)c(Ag+)(2)c(NO3-)(3)a棒的质量 (4)b棒的质量(5)溶液的pH
A.(1)(3) B.(3)(4) C.(1)(2)(4) D.(1)(2)(5)
18.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A. 阳极发生还原反应,其电极反应式:Ni2++2e- =Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
17.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.通入丁烷的一极是正极,电极反应为:2C4H10+26e-+13O2-=4CO2+5H2O
C.通入空气的一极是负极,电极反应为:O2+4e-=2O2-
D.电池的总反应是:2C4H10+13O2 ® 8CO2+10H2O
16.用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为( )
A.0.5mol·L-1 B.0.8mol·L-1 C.1.0mol·L-1 D.1.5mol·L-1
15.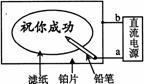 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
A 铅笔端作阳极,发生还原反应
B、铂片端作阴极,发生氧化反应
C 铅笔端有少量的氯气产生 D a点是负极,b点是正极
14.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )
A.CuCl2 [CuSO4] B.NaOH [NaOH] C.NaCl [HCl] D.CuSO4 [Cu(OH)2]
13.银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH- ;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是( )
A、锌为正极,Ag2O为负极; B、锌为阳极,Ag2O为阴极;
C、原电池工作时,负极区PH减小; D、原电池工作时,负极区PH增大;
12.在一定温度下,反应A2(气)+B2(气) 2AB(气)达到平衡的标志是
( )
2AB(气)达到平衡的标志是
( )
A.单位时间内生成nmolA2同时生成nmol的AB B.容器内总压强不随时间而变化
C.单位时间内生成2nmolAB,同时生成nmol的B2
D.单位时间生成nmolA2,同时生成nmol的B2
11.已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1)△H=―Q1 KJ/mol 2H2(g)+O2(g)==2H2O(g) △H=―Q2 KJ/mol 2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol 常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少KJ ( )
A.0.4Q1+0.1Q2 B. 0.4Q1+0.05Q2 C. 0.4Q1+0.1Q3 D.0.4Q1+0.05Q3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com