
题目列表(包括答案和解析)
18.(6分)(1)A的转化率为________; (2)2分钟内生成D的反应速率为____________;
(3)x值等于________________;
17.(12分)
⑴ ⑵
⑶ ⑷
⑸ ⑹
16.⑴(8分)
|
加入物质 变量 |
H2O |
NH4Cl(s) |
NaOH(s) |
浓盐酸 |
|
⑴c(NH3·H2O) |
|
|
|
|
|
⑵n(OH-) |
|
|
|
|
|
⑶c(OH-) |
|
|
|
|
|
⑷电离平衡移动方向 |
|
|
|
|
⑵(2分)
⑶(5分).某温度下,纯水中的c(H+)=1×10-6mol/L,则此溶液中
c(OH-)为 mol/L,溶液的pH为 ;若温度不变时,滴入盐酸,使
c(H+)=1×10-4 mol/L,则溶液中c(OH-)为 mol/L,溶液的pH为 ;若将此盐酸溶液稀释1000倍,则溶液的pH约为 。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 共72分)
15.⑴(2分)①
②
⑵(8分)①下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是________
②则起始读数为_________ mL,终点读数_______ ____mL;
③c(NaOH)= 。
21.⑴.(4分)某温度(T0C)时,测得0. 01 mol·L-1NaOH溶液的pH=11,则该温度下水的KW= 。在该温度下,将100 ml 0.2 mol·L-1的稀盐酸与100 ml 0.4mol·L-1的NaOH溶液混合后,溶液的pH= 。
⑵.(9分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
①将准确称取的wg烧碱样品配成250mL待测液。
②准确量取25.00ml烧碱样品溶液于锥形瓶中并滴加几滴甲基橙指示剂;
③取一滴定管依次用自来水、蒸馏水洗净,然后注入m mol/L标准硫酸溶液,调整液面,记下开始刻度数V1 ml
④在锥形瓶下垫一张白纸,滴定到终点,记录终点耗酸体积V2ml。
试回答下列问题:
(1)步骤②应使用 量取。
(2)滴定时两眼应注视 ,直到滴定到终点。
(3)步骤④当待测液由________色变为________色且30s不再变化即达终点。
(4)烧碱样品的实际纯度比所测纯度应__________________(“偏大”、“偏小”或“相等”),造成误差的原因是
_________ __。(若认为没有误差,此问不答)
(5)不考虑误差,该烧碱样品的纯度表达式是_____________________。
 东海县第二中学高二年级化学学科学情调查答案卷
东海县第二中学高二年级化学学科学情调查答案卷
命题人:谭学钱 审核人:肖剑
(满分:120分 考试用时:100分钟)
说明:
答题前,先将班级、姓名、座号等正确填写在答卷指定的区域内。所有试题的答案都必须工整书写在答卷规定的位置,否则无效。
第Ⅰ卷(选择题 共48分)
20.(8分)
 现有可逆反应:aA(g)+ bB(g)
现有可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据下列图示回答:
cC(g)+ dD(g);根据下列图示回答:
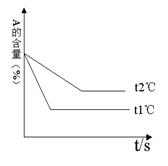
(1)上左图中压强 p1 p2(填“>”、“<”、“=”)
(2)反应式中(a +b) (c +d)(填“>”、“<”、“=”)
(3)上右图中温度t1℃ t2℃(填“高”或“低”)
(4)该反应的正反应为 反应(填“吸热”或“放热”)
18.(6分)在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g) = xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)A的转化率为________; (2)2分钟内生成D的反应速率为____________;
(3)x值等于________________;
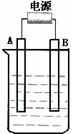 19.(8分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重 1.6 g。请回答下列问题
19.(8分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重 1.6 g。请回答下列问题
(1)A接的是电源的 极。
(2)写出电解时B电极发生反应的电极反应式
。
(3)反应的总离子方程式
。
(4)电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态,则可加入 , [ 填NaOH或CuO或Cu(OH)2 ]
17.(12分)在一定温度下,有a.盐酸b.硫酸c.醋酸三种酸
⑴当其物质的量浓度相同时,c(H+)由大到小的顺序是
⑵同体积、同物质的量浓度的三种酸,,中和NaOH的能力由大到小的顺序是
⑶若三者c(H+)相同时,物质的量浓度由大到小的顺序是
⑷当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是
⑸当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则反应所需时间的长短关系是
⑹将c(H+)相同的三种酸均加到水中稀释到原来浓度的10倍后,c(H+)由大到小的顺序是 。
16.⑴(8分)NH3·H2O的电离方程式为NH3·H2O≒NH4++OH-。若在氨水中加入下表中的物质,氨的电离平衡及平衡时物质的浓度有何变化?请填写下表。
|
加入物质 变量 |
H2O |
NH4Cl(s) |
NaOH(s) |
浓盐酸 |
|
⑴c(NH3·H2O) |
|
|
|
|
|
⑵n(OH-) |
|
|
|
|
|
⑶c(OH-) |
|
|
|
|
|
⑷电离平衡移动方向 |
|
|
|
|
⑵.(2分)在25℃时,若10体积某强酸溶液与1体积某强碱溶液混合后,溶液呈中性,则混合之前该酸的pH与强碱的pH之间应满足的关系是 。
⑶.(5分)某温度下,纯水中的c(H+)=1×10-6mol/L,则此溶液中
c(OH-)为 mol/L,溶液的pH为 ;若温度不变时,滴入盐酸,使
c(H+)=1×10-4 mol/L,则溶液中c(OH-)为 mol/L,溶液的pH为 ;若将此盐酸溶液稀释1000倍,则溶液的pH约为 。
15.⑴(2分)下面所列的是中学化学实验中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯。
①若要进行中和滴定实验,还缺少的玻璃仪器是________________________。
②若要用碳酸钠固体配制一定物质的量浓度的溶液,还缺少的玻璃仪器是 。
⑵(8分)某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
①下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B. 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗
 净后没有干燥
开始 结束
净后没有干燥
开始 结束
C. 酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
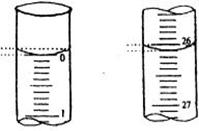
②若滴定开始和结束时,酸式滴定管中的液
面如图所示:则起始读数为_________mL,终点
读数_____________mL;
③某学生根据三次实验分别记录有关数据如下:
|
滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体/mL |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com