
题目列表(包括答案和解析)
28.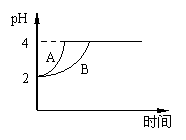 (4分)常温下,取pH=2的盐酸和醋酸溶液各100mL,
(4分)常温下,取pH=2的盐酸和醋酸溶液各100mL,
向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化
如右图所示。则图中表示醋酸溶液中pH变化曲线的是
(填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液
中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)
27.(5分)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。则该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为盐溶液应呈中性,所以可能是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
。
26.(7分)常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L溶液。
(1)溶液中共有 种不同粒子。
(2)这些粒子中浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(3)物质的量之和为0.01mol的两种粒子是 和 。
(4) 和 两种离子数量之和比OH-多0.008mo1。
25.(2分)下列说法中不正确的是 。
①用稀HCl洗涤AgCl沉淀比用水洗涤损耗AgCl小;
②一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的;
③除去溶液中的Mg2+,用OH-沉淀比用CO32-好,说明Mg(OH)2的溶解度比MgCO3大;
④沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全。
24.(8分)(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 性(填“酸”、“中”或“碱”,下同),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”,下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性,溶液中
c(Na+) c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 性,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
23.常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
A.同物质的量浓度的三种溶液的pH:a>b>c
B.同pH时,三种溶液稀释相同倍数后,pH:c>a>b
C.同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c
D.同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
22.下列叙述正确的是
A.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合:
c(Na+)+c(H+) = 2c(CO32-)+c(OH-)
B.某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA-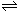 H++A2-则NaHA溶液中:c(Na+) = c(A2-)+c(HA-)+c(H2A)
H++A2-则NaHA溶液中:c(Na+) = c(A2-)+c(HA-)+c(H2A)
C.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.常温下,10 mL pH=12的Ba(OH)2溶液与40 mLcmol·L-1的NaHSO4溶液混合,当溶液中的Ba2+、SO42-均恰好完全沉淀,若混合后溶液的体积为50 mL,则溶液pH=11
21.已知某温度下,在100mL浓度为0.01mol·L-1的NaHB强电解质溶液中,c(H+)>(OH-),则下列关系式一定正确的是
A.溶液的pH=2 B.c(Na+)=0.01 mol/L≥c(B2-)
C.c(H+)·c(OH-)=10-14 D.c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-)
18.已知25 ℃ 时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当AgCl溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液
D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI
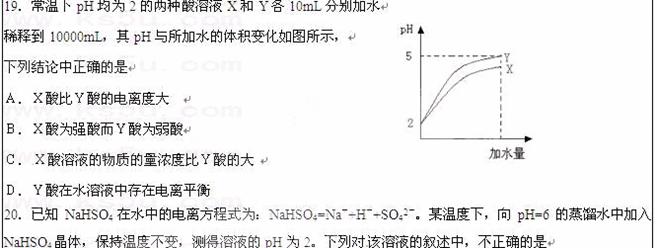
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
17.在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为Amol·L-1与Bmol·L-1,则A和B关系为
A.A>B B.A=10-4 B C.B=10-4 A D.A=B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com