
题目列表(包括答案和解析)
26.CuI是一种不溶于水的白色固体,它可以由反应:
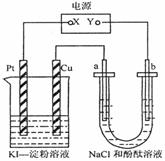 2Cu2++4I-==2CuI↓+I2而得到。如图所示装置中,a、b都是
2Cu2++4I-==2CuI↓+I2而得到。如图所示装置中,a、b都是
惰性电极,通电一段时间后,在KI一淀粉溶液中阳极周围
变蓝色,则下列说法正确的是
A.若a极变红,则在Pt电极上:2 I- 一2e-==I2碘遇淀粉变蓝
B.若b极变红,在Pt电极上:4OH-一4 e-==2H2O+O2O2将I-氧化为I2,碘遇淀粉变蓝
C.若a极变红,在Cu电极上:开始Cu+ I- -e- ==CuI,一段时间后2 I- -2 e-==I2,碘遇淀粉变蓝
D.若b极变红,在Cu极上:Cu-2 e-==Cu2+ Cu2+显蓝色
25.对于可逆反应 2AB3(g) A2(g) + 3B2(g)
△H>0下列图像正确的是K^S*
A2(g) + 3B2(g)
△H>0下列图像正确的是K^S*
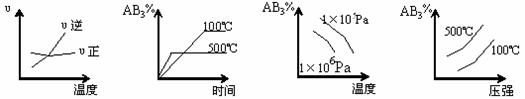
A B C D
24.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=-92.6 kJ/moL。实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=-92.6 kJ/moL。实验测得起始、平衡时的有关数据如下表:
|
容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
|
N2 |
H2 |
NH3 |
||
|
① |
1 |
3 |
0 |
放出热量:23.15kJ |
|
② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ,
23.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e- + OH-== NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
22.化学反应N2+3H2 = 2NH3的能量变化如题13图所示,该反应的热化学方程式是
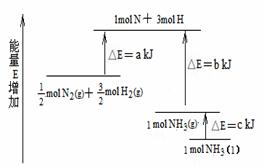 A.
A.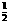 N2(g)+
N2(g)+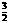 H2(g) =NH3(g);
H2(g) =NH3(g);
△H = (a+b)kJ/mol
B.N2(g)+3H2(g) = 2NH3(g);
△H = 2(b-a)kJ/mol
C.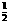 N2(g)+
N2(g)+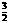 H2(g) = NH3(l);
H2(g) = NH3(l);
△H = (b+c-a)kJ/mol
D.N2(g)+3H2(g) = 2NH3(l);
△H = 2(a-b-c)kJ/mol
21.(7分)某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)
 2NH3(g) ;在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。
2NH3(g) ;在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。
试求:(1)该温度下,反应的平衡常数是多少
(2)用H2表示该反应的反应速率是多少
(3)N2的转化率(保留三位有效数字)
B卷(能力提高题 共50分)
20.(14分) 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g);ΔH= -566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH= -483.6 kJ·mol-1
H2O (g)=H2O(l);ΔH= -44.0 kJ·mol-1
(1)氢气的燃烧热△H= kJ·mol-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 ;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“不变”或“变小”),平衡将向 (填“正”或“逆”)方向移动
(4)为了提高CO的转化率,可采取的措施是 。
A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
19.(12分)已知电极材料:铁、铜、银、石墨、锌、铝;
电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸。
按要求回答下列问题:
①电工操作上规定:不能把铜导线和铝导线连接在一起使用。请用电化学知识说明原因
。
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?
(填“能”或“不能”),若能,请写出电极反应式,负极 ,正极 。
③若发生如下反应:Cu+2H+= Cu2++H2↑,请在右边框图内画出实现该反应的装置图(使用题目所给材料和药品)。
④若用石墨作电极,电解1L 0.1mol/L盐酸,当转移0.5mol电子时,阳极得到气体的体积(标况)为
L
18.(10分)可逆反应C(固)+H2O(气) CO(气)+H2(气)正反应放热。 在一定条件下达到平衡,改变下列条件,正、逆反应速率各怎样变化?化学平衡怎样移动?
CO(气)+H2(气)正反应放热。 在一定条件下达到平衡,改变下列条件,正、逆反应速率各怎样变化?化学平衡怎样移动?
投入焦炭粉末;(2)增加CO;(3)降温;(4)加压;(5)使用催化剂
(反应速率填增大,减小或不变;平衡移动方向填正反应方向,逆反应方向或不移动)
|
|
(1) |
(2) |
(3) |
(4) |
(5) |
|
逆反应速率 |
|
|
|
|
|
|
平衡移动方向 |
|
|
|
|
|
17.(9分)依据事实,写出下列反应的热化学方程式。
(1) 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
__________________________ __________
(2) 用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5 NA个电子转移时,放出650kJ的热量。则C2H2完全燃烧的热化学方程式为
______ _____________________________
(3) 已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
_______________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com