
题目列表(包括答案和解析)
8.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,易燃烧
电石气的杂质中常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的
叙述正确的是 ( )
A.PH3分子中有未成键的孤对电子 B.PH3是非极性分子
C.PH3是一种强氧化剂 D.PH3分子的P-H键是非极性键
7.下列说法正确的是 ( )
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
6.下列四种元素中,其单质的氧化性最强的是 ( )
A.基态原子含有未成对电子最多的第二周期元素
B.位于元素周期表中第三周期第ⅢA族的元素
C.基态原子最外层电子排布为2s22p6的元素
D.基态原子最外层电子排布为3s23p5的元素
5. 下列分子中,不能满足所有原子都满足最外层为8个电子稳定结构的是 ( )
A、BF3 B、CCl4 C、CO2 D、PCl3
3.下列说法中不正确的是 ( )
A.在共价化合物中也可能含有离子键
B.只由非金属元素组成的化学物可能含离子键
C.含有共价键的化合物不一定是共价化合物
D.含有离子键的化合物一定是离子化合物
4对Na、Mg、Al的有关性质的叙述正确的是 ( )
A、碱性:NaOH>Mg(OH)2>Al(OH)3 B、原子半径:Na<Mg<Al
C、离子半径:Na+<Mg2+<Al3+ D、单质的还原性:Al>Mg>Na
2.下列物质中含有非极性共价键的离子化合物是 ( )
A.KOH B.CaCl2 C.Na2O2 D.NH4Cl
1.下列关于价电子构型为3s23p4的粒子描述正确的是 ( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
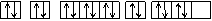 D.其电子排布图为:
D.其电子排布图为:
1s 2s 2p 3s 3p
29.某化学兴趣小组要完成中和热的测定。K^S*
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
|
实 验 用 品K^S* |
溶 液 温 度 |
中和热 △H |
|||
|
t1 |
t2 |
||||
|
① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
|
② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。K^S*
28.(9分)用NaCl做原料可以得到多种产品。
(1) 工业上由NaCl制备金属钠的化学方程式是
__________________ __________________________________。
(2) 实验室用惰性电极电解100 mL0.1 mol/LNaCl溶液。
写出阳极的电极反应方程式: ________________________________________
 若阴阳两极均得到112
mL气体(标准状况),则所得溶液的浓度_____________mol/l(忽略反应前后溶液的体积变化)。K^S*
若阴阳两极均得到112
mL气体(标准状况),则所得溶液的浓度_____________mol/l(忽略反应前后溶液的体积变化)。K^S*
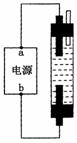
(3) 某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl2被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是_________
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
假设最后所得溶液中仅含一种溶质,则整个过程用一个方程式表示为:
_________ _______________________________________________。
27.(10分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。K^S*
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。K^S*
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
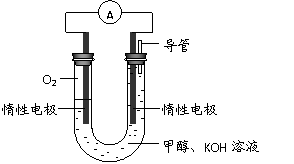
(3)某实验小组依据甲醇燃烧的反应原理,
设计如右图所示的电池装置。 该电池正极的电极反应为 。
② 工作一段时间后,测得溶液的
pH减小,该电池总反应的化学方程式为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com