
题目列表(包括答案和解析)
27. (1)下列由极性键形成的极性分子是 。
(2)下列说法不正确的是 。
(3) 下列推测不正确的是 。
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的 。
(5) 则该配合物的化学式最可能为 。
(6)钴离子在基态时核外电子排布式为: 。
26.推断下列化合物的化学式:
⑴若XY2是离子化合物,其化学式是__ ___;
若XY2是共价化合物其电子式是__ ____。
⑵ 用电子式__ ___。
⑶ 空间构型为_ _____。
⑷ 则该元素的价电子构型是 。
⑸ 用电子式表示该化合物形成过程为:_____ ____ 。
28.四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
⑶D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
 ⑸下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,
⑸下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
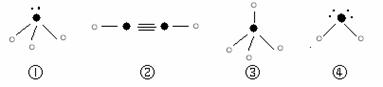
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);
在②的分子中有 个σ键和 个π键。
|
27.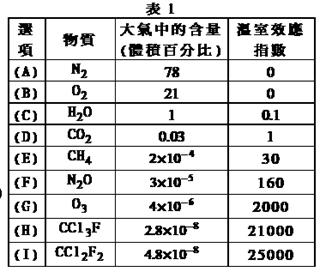 为了比较温室效应气体对目前全球增温现象的影响, 科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
为了比较温室效应气体对目前全球增温现象的影响, 科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,
试 参与回答下列各题:
(1)下列由极性键形成的极性分
子是 。
A.N2 B.O2
C.H2O D.CO2
E.CH4
(2)下列说法不正确的是 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B. C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的 。
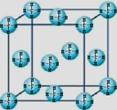 A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某红紫色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成, 且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为 。
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ Co(NH3)5(H2O)]Cl3
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ CoCl(NH3)5]Cl2·H2O。
(6)题(5)中钴离子在基态时核外电子排布式为: 。
26.推断下列化合物的化学式:
⑴X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是_____;若XY2是共价化合物其电子式是______。
⑵第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为:__ ___。
⑶1mol某共价化合物,含有三种短周期元素的原子各1mol,且三种元素分别属于不同的周期,其质子总数为26mol,其中一种元素的最外层有7个电子,其分子的空间构型为_ _____。
⑷某非金属X的最低负价为-2,它的最高价氧化物对应的水化物为强酸,则该元素的价电子构型是 。
⑸X元素的最高正价和负价绝对值之差为6,Y元素的化合价为+1,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物形成过程为:______ ___ 。
25.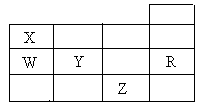 右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
( )
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
( )
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
24. 下列关于丙烯(CH3-CH =CH2)的说法正确的 ( )
A.丙烯分子有8个σ键,1个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键
D.丙烯分子中3个碳原子在同一直线上
23. 下列说法中错误的是: ( )
A.SO2、SO3都是极性分子
B.在NH4+ 和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
22.据报道,有科学家用激光将置于铁室中石墨靶上的碳原子炸松,与此同时再用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜。据称,这种化合物可能比金刚石更坚硬。其原因可能是 ( )
A.碳、氮原子构成平面结构的晶体
B.碳氮键比金刚石中的碳碳键更短
C.氮原子最外层电子数比碳原子最外层电子数多
D.碳、氮的单质化学性质均不活泼
21. 下列说法中,正确的是 ( )
A.冰融化时,分子中H-O键发生断裂
B.原子晶体中,共价键的键长越短,通常熔点就越高
C.分子晶体中,共价键键能越大,该分子的熔沸点就越高
D.分子晶体中,分子间作用力越大,则分子越稳定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com