
题目列表(包括答案和解析)
21.(7分)已知某温度下,Kw=l×10-13。A为酸溶液,其pH=a;B为碱溶液,其pH=b。 (l)若A为强酸,B为强碱,且a + b=13,两者等体积混合后,溶液的pH= ;若此时溶液中阳离子浓度大于阴离子浓度,其原因可能是(用文字表述)___________________________________________________________ (2)若A的化学式为HR, B的化学式为MOH,且a + b = 13。若两者等体积混合 后溶液显碱性,则其原因可能是_________________________________________, 此混合后的溶液中,微粒浓度大小关系一定正确的是_______________填序号)。 ① c(MOH)> c ( M + ) > c ( R一)> c ( H + ) > c ( OH一) ② c ( HR ) > c ( M + ) > c ( R一)> c ( OH一)> c ( H + ) ③ c(M +)> c ( R一)> c ( H + ) > c ( OH一) ④ c ( M + ) > c ( R一)> c ( OH一)>c(H +) ⑤ c ( M + ) + c ( H + ) = c ( R 一)+ c ( OH一) ⑥ c ( MOH ) = c (H +)-c(OH一)
20.(8分)在0.5L的密闭容器中,一定量的氮气和氢气进行
|
t/℃ |
200 |
300 |
400 |
|
K |
K1 |
K2 |
0.5 |
如下化学反应:N2(g)+3H2(g)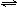 2NH3(g)
⊿H<0,
2NH3(g)
⊿H<0,
其化学平衡常数K与温度t的关系如右表:
请完成下列问题;
(1)试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
(2)下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.υ(N2)正=3υ(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数的值为
。
N2(g)+3H2(g)的化学平衡常数的值为
。
当测得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,则该反应的
υ(N2)正 υ(N2)逆 (填写“>”、“=”或“<”)
(4)(3)中反应平衡时,升高温度,NH3转化率 (填“变大”、“变小”、“不变”)
19.(8分)有以下几种物质①干燥的食盐晶体 ②液态氯化氢 ③水银 ④蔗糖 ⑤冰醋酸(纯醋酸晶体)⑥KNO3溶液 ⑦CaCO3固体 ⑧SO3填空回答(填序号):
(1)以上物质能导电的是 ;(2)以上物质中属于非电解质的是 ; (3)以上物质中属于电解质的是 ;(4)属于强电解质的是 。
18.常温下,下列有关叙述正确的是
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序
①>②>③
D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL
17.下列各组离子,能在指定溶液中大量共存的是
①无色溶液中:K+、Cl-、Na+、HCO3一、OH-;②使pH试纸变深蓝的溶液中:K+、
CO3 2一、Na+、A1O2一;③水电离产生的c(H+)=10-12 mol/L的溶液中:ClO-、CO32-、NO3一、NH4+、SO32-;④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na +、SO42一;⑤使甲基橙变红的溶液中MnO4一、NO3一、SO42一、Na+、Fe3+;⑥pH=0的溶液中:Fe2+、Al3+、NO3一、Cl一。
A.①③ B.②④⑤ C. ①②⑤ D. ③⑥
16.某二元酸(H2A)按下式发生电离:H2A=H++HA一;
HA-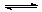 H++A2一。现有下列四种溶液:①0.01 mol·L一1的H2 A溶液;
H++A2一。现有下列四种溶液:①0.01 mol·L一1的H2 A溶液;
②0.01 mol·L一1的NaHA溶液;③0. 02 mol·L一1的HCl溶液与0. 04 mol·L一1的NaHA溶液等体积混合;④0.02 mol·L-1的NaOH溶液与0.02mol·L一1的NaHA溶液等体积混合。下列关于上述四种溶液的说法不正确的是
A.溶液③中有:c(HA一)+c(A2一)=c(Na+)
B.溶液②中存在水解平衡:HA一+H2O 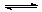 H2A十OH-
H2A十OH-
C.溶液④中有:c(OH一)=(H+)+c(HA一)
D.四种溶液中c(HA一)浓度大小:③>①>②>④
15. 25°C时,在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的是:
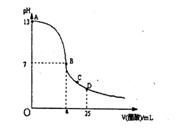 A.在A、B间任一点,溶液中一定都有
A.在A、B间任一点,溶液中一定都有
c(Na+)﹥c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c,( CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+ )
14.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.1 mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42-)>c(NH4+))>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中: c(Na+)+c(H+) =c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
13.向0.1mol/LNa2CO3溶液中加入下列物质或改变某一条件,不能使c(CO32-)/c(Na+)增大的是①固体碳酸钾 ②固体碳酸钠③固体碳酸氢钾 ④固体氢氧化钾 ⑤固体KAlO2 ⑥通入CO2 ⑦升温 A. ② B. ②③ C.②③⑤⑥⑦ D.⑥⑦
12. 向Cr2(SO4)3的水溶液中加入氢氧化钠溶液,当pH=4.6时,开始出现Cr(OH)3沉淀。随着pH的升高沉淀增多,当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-)其平衡关系如下: Cr3+(紫色)+3OH- 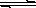 Cr(OH)3(灰绿色)
Cr(OH)3(灰绿色)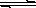 CrO2-(亮绿色)+H++H2O
CrO2-(亮绿色)+H++H2O
向0.05mol/LCr2(SO4)3的溶液50mL中加入1.0mol/L的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为
A.溶液为紫色 B.溶液中有灰绿色沉淀 C.溶液为亮绿色 D.无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com