
题目列表(包括答案和解析)
28、400 mL NaNO3和AgNO3的混合溶液中c(NO3-)=4mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况),假设电解后溶液体积仍为400 mL。试计算
(1)上述电解过程中转移电子的物质的量;
(2)电解后溶液中的C(H+)
审题人:陈平 龙京
 温州中学2009学年第二学期期中考试
温州中学2009学年第二学期期中考试
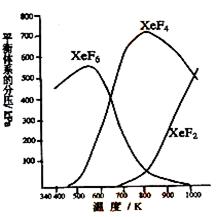
27.(7分)在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(已知气体的分压之比等于物质的量之比)。
⑴ 420K时,发生反应的化学方程式为:
________________________________________,
若反应中消耗1 mol Xe,则转移电子______mol。
⑵ 600~800K时,会发生反应:
XeF6(g)  XeF4(g)
+ F2(g) , 其反应热
XeF4(g)
+ F2(g) , 其反应热
△H________0(填“>”、“=”或“<”),理由是__________________________________________。
⑶ 900K时,容器中存在的组分有 。
26.(7分)25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(OH-)____0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-);(填>、<、=)
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c (Na+)-c (A-)= mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,
①试推断(NH4)2CO3溶液的pH 7 (填>、<、=);
②将相同温度下相同浓度的四种盐溶液:A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
 按pH由大到小的顺序排列
(填序号)
按pH由大到小的顺序排列
(填序号)
25.(6分)现有反应:CO(g)+ H2O(g) CO2(g)+
H2(g) ;△H<0,在850℃时,平衡常数K=1。
CO2(g)+
H2(g) ;△H<0,在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K____1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和 x molH2,则:
①当x=5.0时,上述平衡向_______(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大小”、“小于”或“等于”)。
24、(8分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2-3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)上述操作步骤①中错误是 (请指出
 具体错误)。由此造成的测定结果 (填偏高、偏低或无影响)。
具体错误)。由此造成的测定结果 (填偏高、偏低或无影响)。
(3)步骤②缺少的操作是
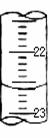
(4)某次滴定时的滴定管中的液面如图,其读数为 mL。若记录读数时,起始时俯视,终点时仰视,则所测溶液浓度会 (填偏高、偏低或无影响)。
(5)根据下列数据:
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.50 |
25.40 |
|
第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为 mol/L。
23.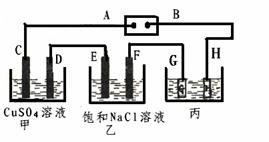 (7分) 如下图所示的装置,C、D、E、F都是惰性电极。
(7分) 如下图所示的装置,C、D、E、F都是惰性电极。
将电源接通后,向乙中滴入酚酞试液.在F极附近显红色。试回答以下问题:
(1)电极A的名称是 。
(2)甲装置中电解反应的总化学方程式是
。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56mL(标准状况下)气体,电解后溶液体积为500mL时,求所得溶液在25℃时的pH =__________。
(4)欲用丙装置给铜镀银,G应该是 (填“银”或“铜”), 电镀液的主要成分是(填化学式) 。
22.(6分)(1)某温度(t℃)时,水的Kw=10-13 mol2·L-2,则该温度(填大于、小于或等于) 25℃,其理由是 。
(2)将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b= ;
②若所得混合液的pH=2,则a∶b= ;
21.(7分)(1)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为:
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是
(3)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a b相连,a为负极;c d相连,c为负极;a c相连,c为正极;b d相连,b为正极,则四种金属的活动性由强到弱顺序为:
(4)写出Na2CO3溶于水后的电离方程式: ________________________________________________________
(5)写出氯化铁溶液水解反应的离子方程式: ______________________________________________
20、T℃时,A气体与B气体反应生成C气体. 反应过程中A、B、C浓度变化如图(Ⅰ)所示,并于t1时刻达到平 衡;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图(Ⅱ)所示. 则下列结论正确的是( )
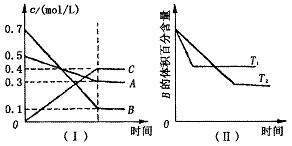
A. 在(t1+10)min时,保持其它条件不变,增大压强,平衡逆向移动
B. 其它条件不变,升高温度,A的转化率一定增大
C. T℃时,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,c(C)仍为0.4mol/L
D. (t1+10) min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
19.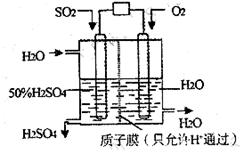 某研究小组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是( )
某研究小组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是( )
A.该装置为电解池,通入O2的电极是阳极
B.该装置中,通入SO2的电极的电极反应式为:SO2-2e-+O2-+H2O=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,若通人SO2速率为2.24 L·min-1,则通入O2速率应为1.12 L·min-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com