
题目列表(包括答案和解析)
1.已知:H2(g)+I2(g) 2HI(g);△H <
0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1
mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡
2HI(g);△H <
0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1
mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡 欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度
B.甲中加入0.1 mol He,乙不变
C.甲降低温度,乙不变
D.甲增加0.1 mol H2,乙增加0.1 mol I2
27.(7分)
将4 mol SO2与2 molO2放人4 L的密闭容器中,在一定条件下反应达到平衡:
2SO2(g)+O2(g)  2SO3(g) ,测得平衡时混合物总的物质的量为5 mol,求:
2SO3(g) ,测得平衡时混合物总的物质的量为5 mol,求:
(1)平衡时各物质的物质的量浓度; K^S*5U.C#O%
(2)该温度下的平衡常数;
(3)平衡时SO2的转化率。
附加题:(20分)
26.(5分)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。
2CO2+N2。
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间(s) K^S*5U.C#O% |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)(mol/L) |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)(mol/L) |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
25.(10分)将等物质的量的A、B、C、D四种物质混合,发生如下反应aA+bB cC(s)+dD。当反应进行一定时间后,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2mol,D增加了n mol,此时达到平衡
cC(s)+dD。当反应进行一定时间后,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2mol,D增加了n mol,此时达到平衡
该化学方程式中各物质的化学计量数为:
a= ,b= ,c= ,d= 。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态。
A: B: C: D:
(3)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应的正反应为
反应(填“吸热”或“放热”) 
24. (8分)反应2A B+C,在某一温度时,达到平衡。
(8分)反应2A B+C,在某一温度时,达到平衡。
(1)若温度升高,化学平衡正向移动,则正反应是_____热反应;
(2)若B是固体,降低压强时,平衡逆向移动,则A是_____态; K^S*5U.C#O%
(3)若A是气态,加压时,平衡不移动,则B为___________态,C为___________态。
23.(4分)反应A + 3B = 2C + 2D在四种不同情况下的反应速率分别为:
①V(A)=0.15mol/(L·s) ②V(B)=0.6mol/(L.s)
③V(C)=0.4mol/(L·s) ④V(D)=0.45mol/(L.s)
该反应进行的快慢顺序为________________。
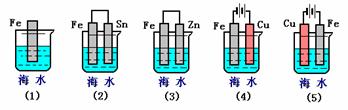
22.(3分)下列各情况,在其中Fe片腐蚀由快到慢的顺序是
21.(3分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
___________________________ _______。
20.在1L密闭容器中通入2mol氨气,在一定温度下发生反应;2NH3  N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是( )。
N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是( )。
A.3mol H2和1mol N2 B.4mol NH3
C.2mol N2和6mol H2 D.2mol NH3、1mol N2、3mol H2
19.根据下列事实,判断离子的氧化性顺序为( )。
①A+B2+=A2++B ②D+2H2O=D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-→E,B→B2+ +2e-
A.D2+>A2+>B2+>E2+ B.D2+>E2+>A2+>B2+
C.E2+>B2+>A2+>D2+ D.A2+>B2+>D2+>E2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com