
题目列表(包括答案和解析)
23.某实验小组用酸碱中和滴定法测定食醋的总酸含量(g/100mL,溶质以醋酸计),回答实验中相关的问题。
22. (9分)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质
 的量随时间的变化如表所示。
的量随时间的变化如表所示。
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
(1)体系中发生反应的化学方程式是
;
(2)该反应在0-3min时间内用产物Z
表示的平均反应速率:________;
(3)该反应达到平衡时反应物X的转
化率为________;
(4)如果该反应是放热反应。改变实
验条件(温度、压强、催化剂)
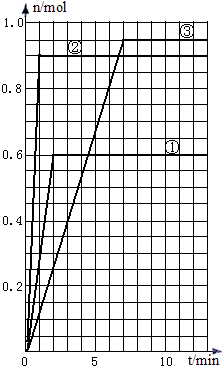
得到Z随时间变化的曲线①、②、
③(如右图所示),则曲线①、②、
③所对应的实验条件改变分别是:① ________、②_________、③_________。
21.(19分)(1)A . NH3 B. SO3 C.Cl2 D. BaSO4 E. 酒精 F. CH3COONH4
G.HClO 。以上物质中属于非电解质的是 ;属于强电解质的是 。
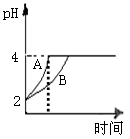 (2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2(填“<”、“=”、“>”)
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2(填“<”、“=”、“>”)
(3)在25℃时,有pH为a(a≤6)的盐酸和pH为b(b≥8)的NaOH溶液,取Va L该盐酸,与该NaOH溶液中和,需Vb LNaOH溶液。若a + b >15,则Va∶Vb = (填表达式),且Va ___Vb(填“>”“<”或“=”)。
(4)已知:CO2+3H2O+2AlO2- = 2Al(OH)3↓+CO32- 。现有浓度为0.1 mol·L-1的五种溶液
A.Na2CO3 B. NaHCO3 C. NaAlO2 D. CH3COONa E. NaOH。这五种溶液的pH由小到大的顺序是 (填编号)
(5)常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液。该溶液中存在的三个平衡体系,它们是:水的电离H2O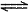 H++OH-、____________________、___________________(用电离或离子方程式表示);在此溶液中浓度为0.01mol/L的微粒是
,浓度为0.002mol/L的微粒是 ; 和 两种微粒的物质的量之和比OH-多0.008mol。
H++OH-、____________________、___________________(用电离或离子方程式表示);在此溶液中浓度为0.01mol/L的微粒是
,浓度为0.002mol/L的微粒是 ; 和 两种微粒的物质的量之和比OH-多0.008mol。
20.室温下,下列溶液中微粒的物质的量浓度关系不正确的是:
A.向0.01 mol/L NH4HSO4溶液中滴加稀NaOH溶液至中性:
c(Na+)> c(SO42-)> c(NH4+)> c(OH-)= c(H+)
B.0.1 mol/L NaHCO3溶液:c(Na+)> c(HCO3-)> c(OH-)> c(H+)
C.Na2CO3溶液:c(OH-)-c(H+) = c(HCO3-) + c(H2CO3)
D.0.01 mol/L的NaHB溶液:c(Na+) = 0.01 mol/L ≥c(B2-)
19.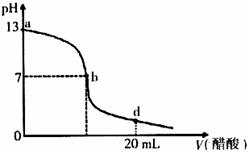 向20 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是:
向20 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是:
A.该NaOH溶液的物质的量浓度
为0.1 mol/L
B.在b点,c (Na+)= c(CH3COO-)
C.在d点,溶液中离子浓度由大到
小的顺序为 c (CH3COO-)>
c (Na+)>c (H+)>c (OH-)
D.氢氧化钠溶液与醋酸溶液恰好完全反
应的点位于曲线b、d之间的某点
18.已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m1 g的镀锌铁皮与石墨用导线相连,放入6mol/L NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片用水冲洗、烘干后称量,得质量为m2 g。下列说法正确的是:
A.设锌镀层单侧厚度为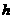 cm,锌的密度为
cm,锌的密度为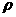 g/cm3,则
g/cm3,则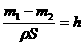
B.m1 -m2为放出H2的质量
C.取出的铁片用水冲净后,放在空气中灼烧,冷却,称量,测得锌的厚度偏小
D.镀锌铁皮电极上发生还原反应
17.在25℃时,纯水的电离度为α1,pH=3的醋酸中水的电离度为α2,pH=11的氢氧化钠溶液中水的电离度为α3。若将上述醋酸溶液和氢氧化钠溶液按一定体积混合,使他们恰好完全反应,反应后所得溶液中水的电离度为α4,则下列关系正确的是:
A. α2=α3<α1<α4 B.α3<α2<α1<α4 C.α1<α3<α2<α4 D.α2=α3<α4<α1
16.常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×10-10、5.0×10-13、8.3×10-17。下列有关说法错误的是:
A.常温下在水中溶解能力AgCl>AgBr>AgI
B.在AgCl饱和溶液中加入浓NaBr溶液有AgBr沉淀生成
C.在AgBr饱和溶液中加入足量饱和NaCl溶液不可能有AgCl沉淀生成
D.在AgI饱和溶液中加入NaI固体后溶液中的c(Ag+) ≠ c(I-)
15.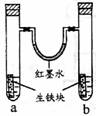 右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和
右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和
氯化铵溶液,各加入生铁,放置一段时间。下列有关描述错误的是:
A.生铁块中的石墨是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe – 2e- = Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
14. 下列的有关实验操作中,不合理的是:
A. 用电子天平秤取4.7385克NaCl固体
B. 用10.00mL规格的移液管移取10.00mL稀盐酸
C. 用酸式滴定管量取12.00mL高锰酸钾溶液
D. 用pH试纸测定某溶液的pH值时,应先润湿pH试纸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com