
题目列表(包括答案和解析)
18.(19分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。

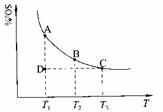 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 ①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒
压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或 “不”);
若在固定容积的密闭容器中发生反应,起始时SO2和O2分别为1mol和0.5mol,达到平衡时SO2的转化率为90%。则从SO3开始进行反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量 ,转化率为
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,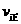
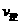 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①写出自然界固氮的化学反应方程式: 。
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时
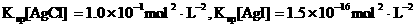 )
)
17.常温下,甲、乙两杯醋酸的稀溶液,甲的pH=2,乙的pH=3,对下列叙述的判断不正确的是
A.甲中水电离出的H+的物质的量浓度是乙中水电离出的H+的物质的量浓度的1/10
B.物质的量浓度c(CH3COOH)甲>10c(CH3COOH)乙
C.中和等量NaOH溶液需甲乙两杯醋酸溶液的体积:10V(CH3COOH)甲>V(CH3COOH)乙 D.甲中的c(OH-)为乙中c(OH-)的1/10
慈溪中学高二(1-3)班期中检测化学试卷
非选择题
16.在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L-1.下列判断正确的是
A.该条件下此反应的平衡常数约为0.91
B.2min内A的反应速率为0.3mol·(L·min)-1
C.B的转化率为60%
D.若混合气体密度不变,则表示该反应达到平衡状态
15.已知相同条件下HBrO比H2CO3酸性弱,HCO3-比HBrO难电离,则下列说法不正确的是
A.结合质子的能力:CO32->BrO-
B.相同浓度时溶液的碱性:NaBrO > NaHCO3
C.反应CO2+NaBrO+H2O→NaHCO3+HBrO可以发生
D.反应CO2+2NaBrO+H2O→Na2CO3+2HBrO可以发生
14.下列有关离子浓度的关系正确的是
A. 0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
C.0.1mol/L NaHA溶液的pH=3: c(HA一) >c(H+) >c(H2A)>c(A2-)
D.新制氯水中 c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
13.在1 LK2SO4和CuSO4的混合溶液中,c(SO42-)=2.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标况)气体,则原溶液中K+的物质的量浓度为
A.2.0 mol·L-1 B.1.5 mol·L-1 C.1.0mol·L-1 D.0.5 mol·L-1[,
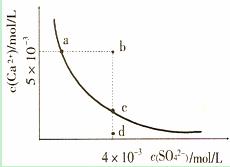
12.常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图。下列说法正
确的是
A.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42-)对应曲线上任意一点
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
11. 已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO
已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO .某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中不正确的是
.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中不正确的是
A.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.c(H+)=c(OH-)+c(SO42-)
10.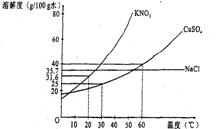 下图是几种盐的溶解度曲线,根据曲线判断下列说法正确的是
下图是几种盐的溶解度曲线,根据曲线判断下列说法正确的是
A.20℃时,硝酸钾饱和溶液的质量分数是31.6%
B.30℃时,将35 g硝酸钾和35g食盐同时溶于l00g水中,蒸发时先析出的是氯化钠
C.40℃时,35 g食盐溶于l00 g水中,降温至0C时,可析出氯化钠晶体
D.60℃时,200 g水中溶解80 g硫酸铜达饱和,当降温至30℃时,可析出30g硫酸铜晶体
9. 下列事实中,不能用勒夏特列原理解释的是
A 氨水应密闭保存,放置低温处
B 在硫酸亚铁溶液中,加入铁粉以防止氧化变质
C 生产硝酸的过程中使用过量空气以提高氨气的利用率
D 实验室常用排饱和食盐水的方法收集氯气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com