
题目列表(包括答案和解析)
5.A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是 ( )
A.A和B一定是同分异构体 B.A和B不可能是同系物
C.A和B最简式一定相同 D.A和B的化学性质相似
4、在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是( )
A、92.3% B、87.6% C、75% D、84%
3、 NA为阿伏加德罗常数,下列说法正确的是( )
A、标准状况下,11.2L的戊烷所含的分子数为0.5NA
B、28g乙烯所含共用电子对数目为4NA
C、标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
2.一种烃的结构式可以表示为:
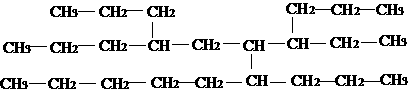
命名该化合物时, 主链上的碳原子数是
A.9 B.11 C.12 D.13
1.2008年九月我国发现三鹿、蒙牛等品牌婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因是奶粉中含有一种叫三聚氰胺的物质,它的分子式为C3N6H6,是一种白色无味的单斜棱晶体。下列有关三聚氰胺的说法不正确的是:( )
A.它是一种含氮的有机化合物 B.它的相对分子质量为126g/mol
C.它易溶于苯、四氯化碳等有机溶剂
D.由于它的含氮量高,被不法商人添加到奶粉中,以提升奶粉检测中的蛋白质含量指标
25.(15分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
该工艺的主要流程如下。
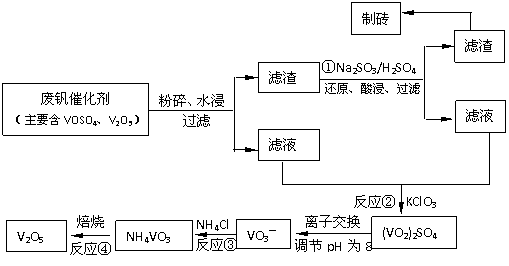 请回答下列问题:
请回答下列问题:
(1)23V在元素周期表位于第 周期 族。工业上由V2O5 冶炼金属钒常用铝热剂法,其用化学方程式表示为 。
(2)反应①的目的是 。
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量: VO2+ + H2C2O4 + H+ → VO2+ + CO2 + ______。
短线上填写物质的化学式或离子符号后,写出配平后完整的离子方程式。
。
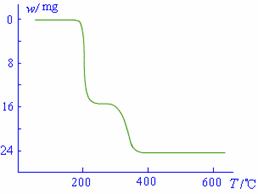 (5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中 。(填序号)
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中 。(填序号)
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
2009-2010学年度下学期开原高中高二第一次考试
24.(11分)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为: 2NO2 + Na2CO3 → NaNO2+ NaNO3 + CO2↑ ① NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ② (1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。 (2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O g。 (3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。 ① 计算吸收液中NaNO2和NaNO3物质的量之比。 ② 1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)(写出计算过程)
23.(6分)4mL O2和3mLNxHy(y>x)混合气体在120℃,1.01×105Pa下点燃完全反应后,恢复到原温度和压强时,测得反应后N2、O2、H2O(气)混合气体密度减少3/10。
(1)NxHy的分子式:
(2)反应的化学方程式:
22.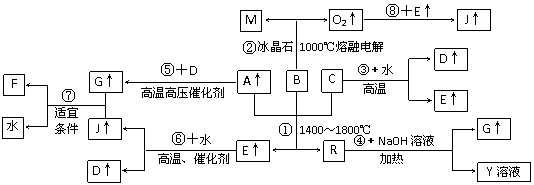 (13分)下图涉及多种无机化工反应,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物,且是一种常见的氮肥,A、C、D、M均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2∶1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B。
(13分)下图涉及多种无机化工反应,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物,且是一种常见的氮肥,A、C、D、M均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2∶1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B。
⑴试写出下列指定物质的化学式:B____ _______,E ,F____ ______。
⑵反应②的阴阳极以 做成, 极材料需要定期更换。两极反应分别为:阳极________________ 阴极_________________________。
⑶反应⑦的化学方程式
⑷反应④的离子方程式为___________________________________________。
21.(20分)海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和金属镁的制备原料都来自于海水。
(I)在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如下图1所示)
⑴ 写出两极电极反应式,阳极 ,阴极 ;
⑵ 图1中a和b分别是 、 ;
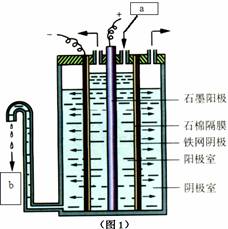 ⑶
石棉隔膜的作用
。
⑶
石棉隔膜的作用
。
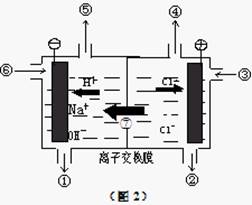
(II)随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子膜电解技术取代。
⑴ 离子膜电解槽(如图2)中⑥⑦分别是 、 。
 ⑵
已知一个电子的电量是1.602×10-19C,在离子膜电解饱和食盐水时通过电子1.929×105 C,则产生氯气
mol,氢气
L(在标准状况下),NaOH g。
⑵
已知一个电子的电量是1.602×10-19C,在离子膜电解饱和食盐水时通过电子1.929×105 C,则产生氯气
mol,氢气
L(在标准状况下),NaOH g。
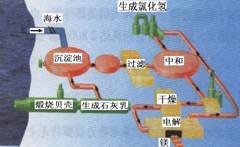
(III)右图是工业上生产镁的流程。
(1)写出下列反应的化学方程式:
①沉淀池中 ;
②电解 ;
(2)整个生产流程中循环使用的物质是 。
(3)简述把氯化镁的水合晶体加热使之脱水转化为无水氯化镁的操作过程 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com