
题目列表(包括答案和解析)
3.1gH2燃烧生成液态水放出142.9KJ的热量,表示该反应的热化学方程式正确的是
 A.
2H2(g)+O2(g)=2H2O(l)
; ΔH=-142.9kJ·mol-1
A.
2H2(g)+O2(g)=2H2O(l)
; ΔH=-142.9kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) ; ΔH=-571.6kJ·mol-1
C. 2H2+O2=2H2O ; ΔH=-571.6kJ·mol-1
D. H2(g)+1/2O2(g)=H2O(g) ; ΔH=--285.8kJ·mol-1
2.已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
 H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
A.50 B.0.02 C.100 D.无法确定
1.一定条件下反应N2(g)+3H2(g)  2NH3(g
)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
2NH3(g
)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
A.1.2mol/(L·min) B.1mol/(L·min) C.0.6mol/(L·min) D.0.4mol/(L·min)
19.(共12分) 在某温度下,将H2和I2各0.10mol 的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得 c(H2)= 0.0080mol/L
⑴求该反应的平衡常数。▲(要有解题过程)
⑵在上述温度下,该容器中若通入H2和I2各0.20mol 的气态混合物,试求达到化学平衡状态时各物质的浓度。▲(要有解题过程)
113.5kJ的热量,试写出甲醇燃烧的热化学方程式: ▲ 。
⑵ 已知:Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)ΔH=-226kJ/mol 则反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g ) ΔH ▲ -452kJ/mol(填“>”、“<”、“=”)
⑶由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
|
化学键 |
H-H |
N-H |
N≡N |
|
键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g) 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的数值:___▲___。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的数值:___▲___。
⑷ 依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:__▲_。
18. (共12分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(共12分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
⑴ 实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出
17.(共12) 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:
⑴该反应的化学平衡常数表达式为K = ▲ 。
⑵该反应为 ▲ 反应(选填吸热、放热)。
⑶能判断该反应是否达到化学平衡状态的依据是 ▲ (多选扣分)。
a.容器压强不变 b.c(CO)不变 c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
⑷某温度下,平衡时:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ▲ ℃。
16.(共16分) ⑴现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
① 酸式滴定管用蒸馏水洗净后,还应该进行的操作是___▲___。
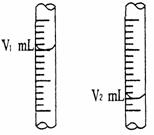 ② 右图是酸式滴定管中液面在滴定前后的读数:
② 右图是酸式滴定管中液面在滴定前后的读数:
 试用有关符号表示该待测NaOH溶液的物质的量浓度:c (NaOH) = ___▲___ mol/L。
试用有关符号表示该待测NaOH溶液的物质的量浓度:c (NaOH) = ___▲___ mol/L。
③ 若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏___▲___。
⑵已知空气中含有N2、O2、CO2、H2S等气体。试判断下列滴定操作的终点、分析出现下列现象的原因。(或用有关离子方程式表示)
① 以酚酞为指示剂,碱液滴定酸液,到 ▲ 为终点。30s后导致褪色的原因: ▲ 。
② 以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32-+I2 = S4O62-+2I-)到 ▲ 为终点,约5min后溶液又显色的原因: ▲ 。
15.(共10分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
⑴配制250 mL 0.2 mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、__▲__和___▲___。
⑵为标定某醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
|
实验序号 |
1 |
2 |
3 |
4 |
|
消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为___▲____。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下,回答下列问题:
|
醋酸浓度(mol/L) |
0.0010 |
0.0100 |
0.0200 |
0.1000 |
0.2000 |
|
pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
⑶根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是__▲___
⑷从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度__▲__。(填增大、减小或不变)
14.(共7)将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了n/2mol,C增加了3/2n mol,D增加了nmol,此时达到化学平衡。
cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了n/2mol,C增加了3/2n mol,D增加了nmol,此时达到化学平衡。
⑴该化学方程式中各物质的化学计量数为:
 a =___▲___,b =___▲___,c
=___▲___,d =___▲___。
a =___▲___,b =___▲___,c
=___▲___,d =___▲___。
⑵若只改变压强,反应速率发生变化,但平衡不移动,该反应中各物质的聚集状态:高A___▲___,B____▲___, D____▲___。
⑶若只升高温度,反应一段时间后,测得四种物质的物质的量又达到相等,则该反应为__▲___反应(填“放热”或“吸热”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com