
题目列表(包括答案和解析)
8. 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g) H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为( )
H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为( )
A. 9 B. 16 C. 20 D. 25
7. 下列说法错误的是( )
A. NH4NO3 溶于水虽然吸热,但其溶于水是自发过程
B. 过热液体(温度高于沸点)会自发转变成气体,可用焓变解释。
C. 对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值通常最小
D. 由能量判据和熵判据组合而成的复合判据,更适合于所有的过程
6.下列有关实验操作的叙述正确的是:( )
A.中和滴定实验中指示剂不宜加入过多,通常量控制在1至2mL
B.用50mL酸式滴定管可准确量取25.00mLKMnO4 溶液
C.用量筒量取5.00mL1.00mol·L-1 盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100mol·L-1 盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
5. 下列事实不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
4. 反应2SO2+O2=2SO3,经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为( )
A.0.1s B.2.5s C.5s D.10s
3. 下列叙述正确的是( )
A. pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B. 溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C. 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D. 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
2. 能源可划分为一级能源和二级能源。自然界中以现成形式提供的能源称为一级能源,需依靠其它能源的能量间接制取的能源成为二级能源。下列能源是一级能源的是( )
A.电能 B.太阳能 C.氢能源 D.单质硅能源
1. 现阶段我国的能源结构仍以化石能源为主,为减少化石能源消耗、实现可持续发展,我国提出了“构建节约型社会”的口号。下列节约化石能源的措施不切实际的是( )
A.大力开发氢能源 B.充分利用太阳能
C.不使用含碳的能源 D.提高能源利用率
22.(16分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?

21.(11分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母) 。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+ H2(g) △H=64.39KJ·mol-1
2H2O2(l)=2H2O(l) + O2(g) △H= -196. 46KJ·mol-1
H2(g) + 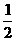 O2(g) = H2O(l) △H= -285. 84KJ·mol-1
O2(g) = H2O(l) △H= -285. 84KJ·mol-1
在H2SO4溶液中Cu与H2O2 反应生成Cu2+ 和H2O的热化学方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3 .0 mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 (×10-3 mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com