
题目列表(包括答案和解析)
3、关于实验室制备乙烯的实验,下列说法正确的是 ( )
A. 反应物是乙醇和过量的3 mol / L硫酸的混合液
B. 温度计插入反应溶液液面以下,以便控制温度在140℃
C. 反应容器(烧瓶)中应加入少许瓷片
D. 反应完毕先灭火再从水中取出导管
2、下列关于甲苯的实验事实中,能说明侧链对苯环性质有影响的是 ( )
A.甲苯通过硝化反应生成三硝基甲苯 B.甲苯能使酸性高锰酸钾溶液褪色
C.甲苯燃烧时产生浓烈的黑烟 D.1mol甲苯可与3mol氢气发生加成反应
1、下列反应属于取代反应的是 ( ) A.苯与浓硝酸、浓硫酸混合共热制取硝基苯
B.乙炔与溴水反应制1,1,2,2-四溴乙烷
C.乙醇使酸性重铬酸钾溶液变色 D.在一定条件下苯与氢气反应制取环己烷
33. 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
吉林毓文中学2009-2010学年度下学期期中考试
32.(10分)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
 (1)钛有4822Ti和5022Ti两种原子,它们互称为
。Ti元素在元素周期表中的位置是第 周期,第 族;按电子排布Ti元素在元素周期表分区中属于
(1)钛有4822Ti和5022Ti两种原子,它们互称为
。Ti元素在元素周期表中的位置是第 周期,第 族;按电子排布Ti元素在元素周期表分区中属于
(填s、P、d、ds或f)区元素。
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有 ● Ti
。 Ba
应用。偏钛酸钡为离子晶体,晶胞的结构如右图 O O
所示,它的化学式是 。
31.A、B、C是原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2。请回答:
(1)D元素较稳定的化合价是 。
(2)C与A形成的最简单分子是 分子(填:“极性”或“非极性”)。
(3)在烃中,若要求所有的原子都有可能在同一个平面中,则对碳原子成键轨道的要求是:
(4)在金刚石晶体的一个晶胞(如图1)中,含有 个碳原子。
(5)铁晶体的晶胞结构(如图2):若铁原子的半径是r cm,则铁的密度是 。

29、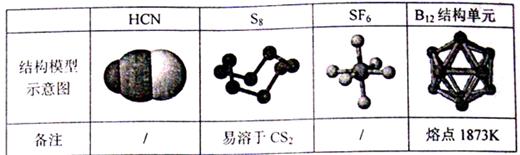 观察下列模型,结合有关信息进行判断,下列说法错误的是( )。
观察下列模型,结合有关信息进行判断,下列说法错误的是( )。
A.HCN的结构式为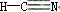 B.固态硫S8属于原子晶体
B.固态硫S8属于原子晶体
 C.SF6是由极性键构成的非极性分子
C.SF6是由极性键构成的非极性分子
D.单质硼属原子晶体,结构单元中含有30个B-B键
30某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的
大小和形状(如图所示)相同。则这种纳米颗粒的表面
粒子数占总粒子数的百分数为( )。
A、87.5% B、92.9% C、96.3% D、100%
28.下列图像是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判属
于NaCl晶体结构的图像是( )。

A.图⑴和图⑶ B.图⑵和图⑶ C.只有图⑴ D.图⑴和图⑷
27.下列几组顺序排列不正确的是( )。
A.沸点高低:HI>HBr>HCl>HF
B.热稳定性大小:HF>H2O>NH3 >PH3
C.熔点高低:金刚石>食盐>金属钠>冰
D.微粒半径大小:S2->Cl->F->Na+>Al3+
26.在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是( )
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com