
题目列表(包括答案和解析)
28. (11分)下图所示装置中,甲、乙两个烧杯分别依次盛放500mL饱和食盐水、足量的CuSO4溶液,a、b、c、d四个电极均为石墨电极。接通电源,甲中a电极上产生黄绿色气体。经过一段时间后,测得乙中d电极质量增加了1.6g。据此回答问题:
(11分)下图所示装置中,甲、乙两个烧杯分别依次盛放500mL饱和食盐水、足量的CuSO4溶液,a、b、c、d四个电极均为石墨电极。接通电源,甲中a电极上产生黄绿色气体。经过一段时间后,测得乙中d电极质量增加了1.6g。据此回答问题:
(1)电源的N端为________极;
(2)电极b上发生的电极反应式为: _____________________________________;
(3)电极c上生成的气体在标准状态下的体积:________________;
(4)甲溶液的pH为____________(设溶液体积仍为500mL);
(5)欲在丙烧杯中实现铁的表面镀上一层银,则电解质溶液为 ,e电极的材料是: ,f电极的电极反应式为 。
27.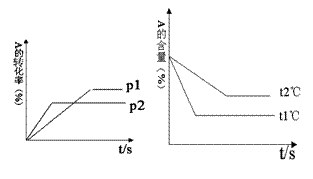 (1)可逆反应:aA(g)+ bB(g)
(1)可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);
cC(g)+ dD(g);
根据右图回答:(4分)
(1)压强 P1比P2 (填大或小);
(2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);
(4)正反应为 反应。 K^S*5U.C#
(2)现有一个装有CuCl2溶液的烧杯,某一电池,两根石墨电极,一根锌电极,一根铁电极,和导线,你能选用上述仪器和药品设计一个简单实验来判断某电池的正负极吗?请你画出进行该实验的装置图,并描述实验现象和结论。(4分) K^S*5U.C#
装置图 实验现象及结论是:_____________________
________________________________________
_______________________________ ______________________________________
26.恒温下,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:(6分)
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 K^S*5U.C# |
|
c(NH3)/mol•L-1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,消耗N2的平均反应速率为___________________________________。
此条件下该反应的化学平衡常数K=__________________________。反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol(其他条件不变),化学平衡将向________________方向移动(填“正反应”或“逆反应”)。
25.将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:
 2SO2(g)
+ O2(g) 2SO3(g)
[△H<0]在一定条件下,2min末达到平衡状态,测得c(SO3)=0.040mol/L。
(6分)
2SO2(g)
+ O2(g) 2SO3(g)
[△H<0]在一定条件下,2min末达到平衡状态,测得c(SO3)=0.040mol/L。
(6分)
(1)SO2的平衡转化率为 ;
(2)下列措施中,可提高SO2的转化率的有 ;
可使该反应的化学平衡常数K值增大的有 。
A.升温 B.扩大容器体积 C.缩小容器体积 D.降温
E.加入催化剂 F.补充氧气 G.将SO3(g)冷却结晶移出
24. 室温下,将CoCl2溶于浓盐酸中,所得紫色溶液中存在下列平衡:(4分) K^S*5U.C#
Co2++4Cl-  CoCl42- [△H›0]
CoCl42- [△H›0]
粉红色 蓝色
(1)写出上述反应的平衡常数表达式:_______________________________
(2)若将装有该溶液的试管置于热水中,预计可观察到现象是( )
A.溶液仍是紫色 B.溶液呈粉红色 C.溶液呈蓝色
23.25℃时,纯水中c(H+)=1.0×10-7mol·L-1,100℃水的离子积常数为1.0×10-12。据此推测,水的电离是 (填“吸热”或“放热”)过程。100℃时, 纯水的pH是_____。
25℃时,某盐酸的pH=1,该溶液中水电离出的c(H+)=___________________。(5分)
22.(1)金属电化学腐蚀分为吸氧腐蚀和析氢腐蚀。钢铁发生吸氧腐蚀时,正极发生____(填“氧化”或“还原”)反应,负极发生的电极反应式为
_________________________________________。(3分)
(2)氢氧燃料电池是一种高性能电池,总反应为2H2+O2=2H2O,若电解质溶液为稀硫酸,写出该电池的正极反应式:_________________________________________。(2分)
21.(1)已知:C(s)+O2(g)== CO2(g) △H= -393.5kJ/mol (4分)
CO(g)+1/2O2(g)== CO2(g) △H= -283kJ/mol
则1 mol C(s)与O2(g)反应生成CO(g)是 (填“放热”或“吸热”)反应,热量是 kJ,反应的热化学方程式为
。
(2)已知:H-H键能为436 ,N≡N键能为945
,N≡N键能为945 ,N-H键能为391
,N-H键能为391  。写出合成氨反应的热化学方程式:(2分) K^S*5U.C#
。写出合成氨反应的热化学方程式:(2分) K^S*5U.C#
_____________________________________________________________________
20.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如右下表,下列说法正确的是 ( )
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
A.降低温度,可提高H2的转化率
B.该反应为放热反应
C.若容器中压强不变,说明该反应达到化学平衡状态 K^S*5U.C#
D.830℃,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)
厦门六中2009-2010学年(下)期中考
高二化学试卷
注意:本试卷分试Ⅰ卷和Ⅱ卷两部分,共29道题。满分值:100分,考试时间:90分钟。考生只交Ⅱ卷和选择题答题卡。
Ⅱ卷(非选择题)
 相对原子质量:
Cu-64
相对原子质量:
Cu-64
19. 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 K^S*5U.C# |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是 ( )
A.反应达到平衡时,y的转化率为75%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com