
题目列表(包括答案和解析)
29.运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
1)合成氨反应N2(g)+3H2(g)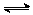 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡____移动(填“向左”“向右”或“不”);使用催化剂______反应的△H(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡____移动(填“向左”“向右”或“不”);使用催化剂______反应的△H(填“增大”“减小”或“不改变”)。
2)在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为___________________________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显___性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=___________。
28.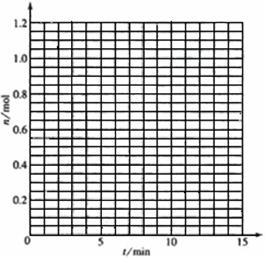
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
2)体系中发生反应的化学方程式是________________________;
3)列式计算该反应在0-3min时间内产物Z的平均反应速率:_____________;
4)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:
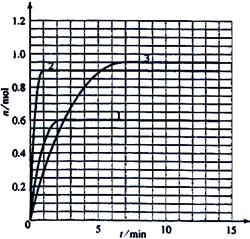 ①_______________
①_______________
②_______________
③_______________
附加题:分数计入总分
27.在一体积为10L的容器中,将1.0molCO与1.0molH2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)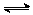 CO2(g)+H2(g) △H<0。5min时该反应达到平衡,测得的H2O(g)物质的量为0.5mol。
CO2(g)+H2(g) △H<0。5min时该反应达到平衡,测得的H2O(g)物质的量为0.5mol。
1)0~5min的平均反应速率υ(CO)=______mol/(L·min)。
2)该温度下此反应的平衡常数K=______(填数值),如果升高温度K值将会__________(填“变大”,“变小”或“不变”)。
3)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____。(填字母)
A.及时分离出H2气体 B.适当升高温度
C.增大H2O的浓度 D.使用高效的催化剂
4)为了提高CO的转化率,可向装置中再充入H2O(g)1.0mol,达新平衡时CO的转化率为__________。
26.1)Na2CO3的水溶液呈_____(填“酸”、“中”、“碱”)性,常温时的pH_____7(填“>”、“=”、“<”),原因是(用离子方程式表示):___________________________;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以_____(填“促进”、“抑制”)其水解。
2)氯化铝水溶液呈____(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):__________________________;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_____;
3)①选用酚酞为指示剂,用标准的NaOH溶液滴定未知浓度的盐酸,造成测定结果偏高的原因可能是_____。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
②滴定时边滴边摇动锥形瓶,眼睛应观察_______。
A.滴定管内液面变化 B.锥形瓶内溶液颜色变化
25.(1)纯水能微弱的电离出___和___(填离子符号),在25℃时,水电离出的离子浓度的乘积为常数,该乘积用Kw表示,叫做___________,该常数随温度的升高而______(填“升高”、“不变”或“降低”)。
(2)按要求正确填空
1)盛放NaF溶液不能用玻璃瓶的原因(用离子方程式表示):_________________________;
2)Al3+和HCO3-不能共存的原因(用离子方程式表示):______________________________;
3)Na2S溶液中离子浓度由大到小的顺序:______________________________。
24.下列表述正确的是
A.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
B.中和等体积、等pH盐酸和CH3COOH溶液所消耗的NaOH物质的量相同
C.pH=2的HA溶液与pH=12的MOH溶液以任意比混合后,所得溶液中都有c(H+)+c(M+)=c(OH-)+c(A-)
D.在水电离出H+浓度为1×10-12mol/L的溶液中,K+、Mg2+、NO3-、I-一定能大量共存
华 北 石 油 第 三 中 学 2009-2010 学 年 度 第 二 学 期
 高 二 月 考 天 津 化 学 试 题
高 二 月 考 天 津 化 学 试 题
第Ⅱ卷(选择题 共52分)
23.物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9。下列有关说法正确的是
A.HX是强酸,HY、HZ是弱酸,且HY的酸性强于HZ
B.三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(Z-)>c(Y-)>c(X-)
C.X-、Y-、Z-三种酸根均能水解,且水解程度Z->Y->X-
D.HX、HY、HZ三种酸的酸性由强到弱的顺序为HZ>HY>HX
22.下列叙述正确的是
A.0.1mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
21.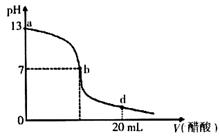 向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是
向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是
A.该氢氧化钠溶液的物质的量浓度为0.1mol/L
B.在b点,c(Na+)=c(CH3COO-)
C.在d点,溶液中所有离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点
20.下列各项中的两个量,其比例为2:1的是
A.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比
B.同温度下,0.2mol/LCH3COOH溶液与0.1mol/L CH3COOH溶液中的c(H+)之比
C.液面在“0”刻度,50mL酸式滴定管和25mL酸式滴定管内所盛溶液的体积
D.0.2mol/L的NH4HSO4溶液中的阳离子与阴离子之比
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com