
题目列表(包括答案和解析)
25.(4分)化合物甲只含C、H两种元素,化合物乙和丙都只含C、H、F三种元素,甲、乙、丙都是饱和化合物且分子中都含有26个电子。据此推断:
(1)甲的分子式是_____________;若甲分子中有两个H原子被F原子代替,所得产物可能有_______种结构。
(2)乙是性能优异的环保产品,它可替代某些会破坏臭氧层的氟里昂产品,用作致冷剂。已知乙分子中C、H、F原子个数比为1∶2∶2,则下列对于乙的描述正确的是____________。
A.其分子构型为正四面体 B.其分子构型为正四边形
C.具有两种同分异构体 D.没有同分异构体
(3)将甲、乙按物质的量之比1∶1混合所得混合物的平均摩尔质量等于丙的摩尔质量,则丙的分子式是______________。
24.(3分)人造羊毛的性能在许多方面比天然羊毛更优良,其分子里存在如下结构:
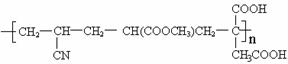
合成它的单体是
____________________________________________________________________________。
23. (5分)(1)化学反应2A(g)+B(?)  2C(g)达到化学平衡时:
2C(g)达到化学平衡时:
①升高温度时,C的量减少,则反应物的能量总和____________生成物的能量总和(填“>”、“<”或“=”)
②如果增大压强,平衡向正反应方向移动,则B是____________态物质
③若增加B的物质的量,平衡不移动,说明B是____________态物质
(2)如图,在恒压密闭容器中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2 A(g)+B(g) x C(g)
x C(g)
平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
根据题中数据计算,x =_________、y =_________;
22.为了使FeCl3溶液中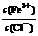 增大,可加入的物质是
增大,可加入的物质是
A.适量的HCl气体 B.适量的硫酸氢钠
C.适量的NaOH固体 D.适量的稀HNO3
第Ⅱ卷(共51分)
21.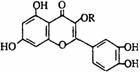 天然维生素P结构如图, 关于维生素P的叙述错误的是
天然维生素P结构如图, 关于维生素P的叙述错误的是
A .可以和浓溴水反应
B. 可和氢气发生加成反应
C.分子中有7个C= C 键
D.1mol维生素P可以和4molNa2CO3反应
20.常温下,下列有关叙述正确的是
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6mol/L
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①=②>③
D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL
19.日前朝鲜一辆载有硝酸铵的列车与另一辆列车相撞导致电线短路继而引发剧烈爆炸,造成重大人员伤亡。硝酸铵受撞击或高温发生爆炸的反应为:
a NH4NO3→b O2+c N2+d H2O 下列关于方程式中化学计量数的说法正确的是
A.a=1 B.b=2 C.c=3 D.d=4
18.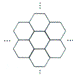 据报道,科学家己经研制出世界上最薄的材料一碳膜片,其厚度只有一根头发的二十万分之一。如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是
据报道,科学家己经研制出世界上最薄的材料一碳膜片,其厚度只有一根头发的二十万分之一。如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是
A.碳膜片属于单质
B.碳膜片与C60是同一种元素形成的不同单质
C.碳膜片属于新型的金属材料
D.碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同
17.下列实验设计能够成功的是( )
|
|
实验目的 |
实验步骤及现象 |
|
A |
检验亚硫酸钠试样是否变质 |
 |
|
B |
检验某卤代烃是否是氯代烃 |
 |
|
C |
证明酸性条件下H2O2氧化性比I2强 |
 |
|
D |
除去氯化钠溶液中的少量硫酸钠 |
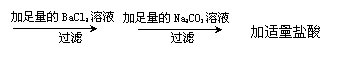 溶液 |
16. 合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%-15%;最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成出氨。下列有关说法中错误的是
A.新的催化剂降低了反应所需要的能量
B.新法合成和哈伯法相比不需要在高温条件下,可节约大量能源
C.新法合成能在常温下进行是因为催化剂降低了反应的活化能
D.哈伯法合成氨是吸热反应,新法合成氨是放热反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com