
题目列表(包括答案和解析)
第Ⅱ卷(非选择题,共55分)
15.下列溶液中微粒的物质的量浓度关系正确的是
A.0.1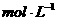
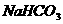 溶液:
溶液: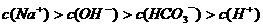
B.室温下,向0.01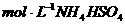 溶液中滴加
溶液中滴加 溶液至中性:
溶液至中性: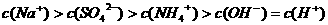
C.Na2CO3溶液: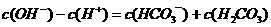
D.25℃时,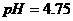 、浓度均为0.1
、浓度均为0.1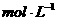 的
的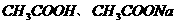 混合溶液:
混合溶液: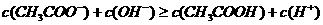
 白鹭洲中学高二下学期第二次月考化学答题卷
白鹭洲中学高二下学期第二次月考化学答题卷
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14.将NH4I(s)置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)。
H2(g)+I2(g)。
达到平衡时,c(I2)=0.4mol·L-1,c(HI)=4.2mol·L-1,则此温度下反应①的平衡常数为 ( )
A.17 B.19 C.21 D.25
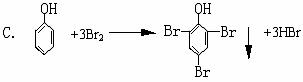
13.在苯和它的衍生物中, 由于侧链与苯环间的相互影响, 从而使它们在性质上都发生了一些变化。但下列反应中不能够说明这一现象的是 ( )
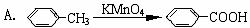

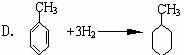
12.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:
 2SO2 (g) + O2 (g) 2SO3 (g) ;△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是 ( )
2SO2 (g) + O2 (g) 2SO3 (g) ;△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是 ( )
A.4molSO2和2molO2 B.5molSO2和3molO2
C.4molSO2和4molO2 D.2molSO2、1molO2和2molSO3.
11.有 ① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是 ( )
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
10.下列各组物质,无论总质量一定或总物质的量一定,它们以任意比混合,耗氧量都不相等的是 ( )
①C2H2与CH3CHO ②CH3OH与CH4 ③C2H2与C6H6 ④HCOOCH3与HCHO
A.② B.① C.②③ D.③④
9.中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是( )
A.用一定量NaOH稀溶液和稀盐酸反应测得的中和热数据,来推算一定量稀H2SO4和NaOH稀溶液反应的反应热
B.用沸点数据推测能否用蒸馏的方法将两种液体混合物进行分离
C.用反应热数据的大小判断不同反应的反应速率大小
D.用原子(或离子)半径数据推断同周期或同主族某些原子(或离子)氧化性或还原性的强弱
7.著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是 ( )
A.电解熔融的CeO2制Ce,铈在阳极获得。
B.铈溶于氢碘酸的化学方程式为:Ce+4HI=CeI4+2H2↑
C.用硫酸铈溶液滴定硫酸亚铁溶液的离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.四种稳定的核素13658Ce、13858Ce、14058Ce、14258Ce它们互称为同位素。
8下列所设计的鉴定方案或者结论正确的是 ( )
A.检验C2H5Cl中的氯元素时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸后进行酸化,再加硝酸银溶液
B.向溶液中加入盐酸,有无色气体逸出,此气体能使澄清石灰水变浑浊,则该溶液中含有CO32-
C.向0.1mol·L-1 FeSO4 溶液中滴加少量酸性KMnO4 溶液,KMnO4 溶液褪色,说明Fe2+具有氧化性
D.向2.0mL浓度均为0.1mol·L-1 的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大.
6.等物质的量的下列物质:①NaHSO4②Ca(H2PO4)2③Si ④Al2(SO4)3 ⑤
分别与足量的氢氧化钠溶液反应,耗碱量由多到少的顺序正确的是:
A.②⑤④③① B.④②⑤③① C. ④②③⑤① D.④⑤②③①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com