
题目列表(包括答案和解析)
29. 煤的“气化”是使煤变成洁净能源的有效途径之一,
煤的“气化”是使煤变成洁净能源的有效途径之一,
其主要反应为:C + H2O CO + H2 下图是用煤为原料合成F的路线图(部分反应条件和生成物已略),D的分子式为C9H10O,且能发生银镜反应。
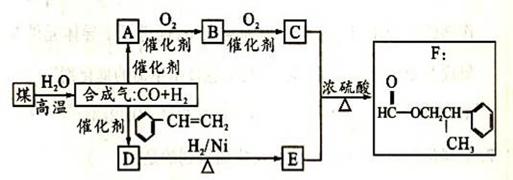
(1) 写出A、D的结构简式:A:_______________ D:________________
(2)关于有机物F的说法正确的是 。
A.属于芳香烃 B.能够发生银镜反应
C.1molF最多可以加成4molH2 D.易溶于水
(3) 写出C与E反应生成F的化学方程式:_________________________________________
(4)“合成气” (CO、H2)除作合成有机物的原料外,还有其他用途,如_______ (举一例).
(5) F有多种同分异构体,满足下列条件的同分异构体有 _____ 种(不包括F).
① 属于酯类, 且能发生银镜反应
② 苯环上的一氯代物只有两种.
③ 分子中只有 两个甲基.
28. 2008北京奥运会吉祥物福娃,已被做成各种玩具。有一种玩具的内充物为无
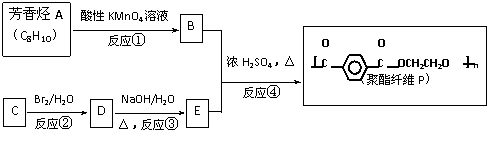 毒的聚酯纤维P,其合成线路如下,其中A、B、C、D、E均为有机物。
毒的聚酯纤维P,其合成线路如下,其中A、B、C、D、E均为有机物。
(1)C的结构简式是 。
(2)反应④的化学方程式是 。
(3)等物质的量的B与E在热的浓硫酸存在的条件下反应,生成1mol有机物x及1mol水,则有机物x的结构简式是 。
(4)指出下列有机反应类型:
反应②属于 反应;反应③属于 反应;反应④属于 反应。
(5)B的同分异构体有多种,其中某种同分异构体y的分子内含有苯环,且y既能与NaHCO3溶液反应放出CO2气体,又能发生银镜反应,还能发生水解反应。
则y的结构简式是 (只写一种)。
26.已知乙醇可以和无水CaCl2反应生成微溶于水的CaCl2•6C2H5OH 。
有关试剂的沸点如下:CH3COOC2H5 77.1℃; C2H5OC2H5 34.5℃;
C2H5OH 78.3℃; CH3COOH 118℃。
某课外小组用如下图所示装置制备乙酸乙酯粗产品,试回答下列问题:
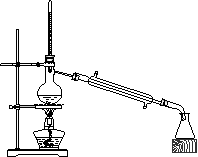 (1)蒸馏烧瓶中加入的试剂是: 冰乙酸、酒精和浓硫酸,
(1)蒸馏烧瓶中加入的试剂是: 冰乙酸、酒精和浓硫酸,
其中浓H2SO4的作用是 和 。
(2)冷凝管中最先冷凝的馏分是 ,
弃去低沸点的馏分。收集沸点在76℃~120℃
之间的馏分,将其倾倒入饱和Na2CO3溶液中观察
到的现象是: 。
上述实验中饱和碳酸钠溶液的作用是_____(填序号)
A.中和乙酸和乙醇;
B.中和乙酸并溶解乙醇;
C.加速酯的生成,提高酯的产率 D.有利于分层析出。
(3)写出上述实验中用CH3COOH、CH3CH218OH和浓硫酸制备乙酸乙酯的化学方程式:
。
(4)分离出粗产品乙酸乙酯,再加入无水CaCl2,震荡分离的目的是:
为了干燥乙酸乙酯可选用的最佳干燥剂为 ________ (填序号)
A.五氧化二磷 B.无水硫酸钠 C.碱石灰 D.固体氢氧化钠
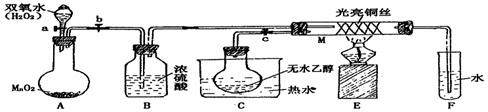 27.有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。
27.有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。
(1)A中发生反应的化学方程式:_______________________________ ,
B的作用:________________________;
(2)M处发生的反应的化学方程式为:______________________________________
(3)该实验过程中催化剂______________ (填“参加”或“不参加”)了化学反应
(4)实验乙醇氧化产物的试剂是 ,并写出对应的化学方程式
。
(5)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含
有 。要除去该物质,可现在混合液中加入 (填写字母)。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
25.
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
e |
|
|
f |
h |
 b b |
c |
|
|
|
|
|
|
|
|
|
|
d |
|
|
|
g |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在元素周期表上述四个区域中,单质均能导电的是 。
(a)A (b)B (c)C (d)D
(2)最外电子层只有圆球形电子云的主族元素在区域 中。
(a)A (b)B (c)C (d)D
(3)e形成的单质晶体可能为 。
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
(4)元素非金属性强弱比较有很多方法,其中f和g的非金属性强弱的研究方案中不可
行的是_________(填序号);
① 比较两种单质的颜色 ② 比较氢化物的稳定性
③ 依据两元素在周期表的位置 ④ 比较原子半径大小
⑤ 比较最高价氧化物对应水化物的酸性
(5) 请用一个化学方程式来说明b的金属性比d强
_____________________________________________________________________
24.现有部分短周期主族元素的描述如下表:
|
元素编号 |
元 素 描 述 |
|
W |
人体内含量最多的元素,且其单质是常见的助燃剂 |
|
X |
第三周期中半径最小的元素 |
|
Y |
原子核外最外层电子排布为nsnnpn |
|
Z |
原子的最外层p亚层电子数等于次外层电子数 |
(1)元素W的原子的电子排布式:____________________
(2)元素X离子的电子式: 。
(3)元素Y的原子核外有 种电子云形状。
(4)元素Z的氢化物充分燃烧后,产生Z的氧化物与水的物质的量之比为2,
写出其中两种氢化物的名称 、 ,
(5)X、Z元素的最高价氧化物对应水化物的酸性强弱: >
(用化学式表示)。
23.根据元素周期表及周期律的知识回答下列问题:
(1)与钠同周期且单质熔点最高的元素位于周期表的第_________周期第_________族。
(2)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2 2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
(3)元素周期表中元素的性质存在递变规律,下列比较正确的是________。
a.离子半径:Na+>Mg2+>S2->Cl-
b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl
d. 还原性:PH3>H2S>HCl>HF
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如下图所示:
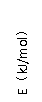
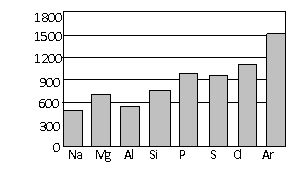
① 同周期内,随着原子序数的增大,E值变化的总趋势是__________________。
② 根据上图提供的信息,试推断E氟_______E氧(填“>”“<”或“=”)。
22. 家用管道煤气的成分是CO、H2、CH4,10 L这种管道煤气充分燃烧,生成CO2和H2O,
同温同压下消耗空气50 L(空气中氧气的体积分数为0.2)。
则该管道煤气中CO、H2、CH4的体积之比可能是 ( )
A.1:1:1 B.3:5:4
C.2:4:5 D.1:6:4
第Ⅱ卷(共84分)
21.麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示。
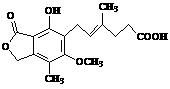 下列有关麦考酚酸说法正确的是(
)
下列有关麦考酚酸说法正确的是(
)
A.分子结构中含有4个碳碳双键
B.1 mol麦考酚酸最多能和5 mol H2发生加成反应
C.麦考酚酸可以与浓溴水发生取代反应
D.1 mol麦考酚酸与足量的NaOH溶液反应,最多可以消耗3mol NaOH
20.下列有关除去杂质(括号内为杂质)的操作中错误的是( )
A. 苯(苯酚):加浓溴水后,过滤
B. 乙烷(乙烯):催化加氢
C. 乙酸乙酯(乙酸):加饱和碳酸钠溶液后,分液
D.乙醇(水):加新制生石灰,蒸馏
19.下列物质性质的变化规律与分子间作用力有关的是 ( )
A.HF、HCl、HBr的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com