
题目列表(包括答案和解析)
34.(3分)氢化钙(CaH2)是一种重要的制氢剂,与水接触时发生如下反应:
CaH2+2H2O = Ca(OH) 2+2H2↑。若要制得2 g氢气,需CaH2的质量为多少?
33.(7分)某同学对“菠菜中富含可溶性草酸盐和碳酸盐,与豆腐同食会引起结石”的说法产生了兴趣。
探究一 菠菜里是否含有可溶性草酸盐和碳酸盐?
[查阅资料]
(1)可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙。
(2)醋酸(化学式用HAc表示)不与草酸钙反应,但能与碳酸钙反应生成可溶性盐。
[实验流程]
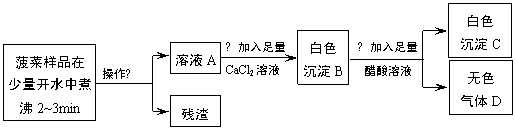
根据流程回答问题:
(1)操作①是_____。
(2)加入足量CaCl2溶液的目的是_____。
(3)已知气体D能使澄清石灰水变浑浊,步骤③的化学反应方程式为_____。
[实验结论]菠菜里含有可溶性草酸盐和碳酸盐。
探究二 人体结石的主要成分是草酸钙,草酸钙高温分解的产物是什么?
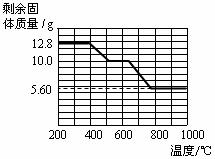 [查阅资料]
[查阅资料]
(1)草酸钙高温完全分解得到两种气态氧化物
和一种固态氧化物。
(2)12.8 g的草酸钙分解过程中温度与剩余固体
的质量关系如右图所示。
[实验分析]
(1)草酸钙高温完全分解的化学方程式为_____。
(2)通过上图数据分析,700℃时剩余固体的成分是_____。
请你设计实验,验证700℃时剩余固体的成分。
|
实验操作 |
实验现象 |
实验结论 |
|
|
|
|
32.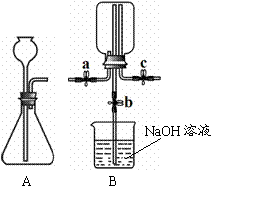 (7分)甲、乙两小组同学分别用下图所示装置(夹持仪器已略去)做兴趣实验。
(7分)甲、乙两小组同学分别用下图所示装置(夹持仪器已略去)做兴趣实验。
(1)甲组实验:
① 在A装置的锥形瓶中加入大理石,向长颈漏斗
中注入稀盐酸,A中反应的化学方程式为_____。
② 连接A、B装置,打开a、c,关闭b,向B中
集气瓶内充入气体,检验集气瓶中气体已收集满
的方法是_____。
③ 关闭a、c,打开b,用冷毛巾捂住B中集气瓶,
一段时间后,观察到B装置中的现象是_____,
B中反应的化学方程式为_____。
(2)乙组实验:
[资料]氯化氢气体和氨气均极易溶于水,且两者反应生成白色固体氯化铵(NH4Cl)。
① 在c右端的导管口套一个气球,在A的锥形瓶中放入浓盐酸,向长颈漏斗中 注入浓硫酸,有HCl气体产生,待A中的空气被排净后,连接A、B装置,打开a、c,关闭b,气球微微鼓起。产生HCl气体的原因是_____。
注入浓硫酸,有HCl气体产生,待A中的空气被排净后,连接A、B装置,打开a、c,关闭b,气球微微鼓起。产生HCl气体的原因是_____。
② 关闭a,将A中的药品替换为NaOH固体和浓氨水,待A中的空气被排净后,连接A、B装置,打开a,一段时间后关闭a,B中集气瓶内有白烟产生。冷却至室温后气球恢复原状。关闭c打开b,B中导管内的液面无任何变化。产生上述现象的原因是_____。
31. (5分)根据下图回答问题。
(5分)根据下图回答问题。
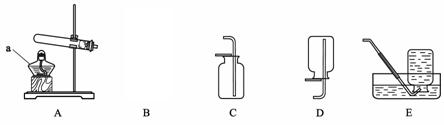
(1)实验仪器a的名称是_____。
(2)实验室用高锰酸钾制氧气的化学方程式为_____,应选用的发生装置是_____(填序号,下同)。
(3)实验室用过氧化氢溶液和二氧化锰制取氧气时,二氧化锰起_____作用,所选用的
收集装置是E或 _____。
_____。
30.(6分)下列用字母表示的7种物质由H、C、O、Na、Cl中的一种或几种元素组成,
它们是初中化学常见的物质。
(1)常温下A、B为液体,A在一定条件下分解生成B和单质M。该反应的化学方程式为_____。
(2)D和E均含有三种元素,且D中各原子个数比为1∶1∶1,G溶液分别与D、E、F溶液反应均可生成B和氯化钠。
①F属于_____(填 “酸”、“碱”、“盐”或“氧化物”)。
②D与G反应的化学方程式为_____,此反应属于基本反应类型中的_____反应。
③若石灰水与E或F反应均得到D的水溶液和一种相同的白色沉淀,则石灰水与E或F反应的化学方程式分别为_____、_____。
29.(6分)金属在生产生活中应用广泛。
(1)用金属铜做电线,主要利用了金属的_____性。
(2)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)炼铁,反应的化学方程式为_____。
每年因腐蚀而报废了大量的铁制品,铁生锈的条件是_____。
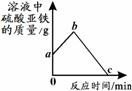 (3)取某溶液少许放入试管中,向其中加入适量的铁粉,充分反应后,向试管中继续加入足量的另一种金属,溶液中FeSO4的质量随时间的
(3)取某溶液少许放入试管中,向其中加入适量的铁粉,充分反应后,向试管中继续加入足量的另一种金属,溶液中FeSO4的质量随时间的
变化如右图所示。试分析:
①若b点表示的溶液中只含一种溶质,则a点表示的
溶液中的溶质可能是_____(写出1种情况即可),
从a点到b点的过程中,反应的化学方程式是_____。
②若从b点到c点的过程中,溶液的质量不断增加,则加入的另一种金属是__ ___。
___。
28.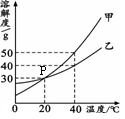 (6分)甲、乙两种固体物质的溶解度曲线如右图所示。
(6分)甲、乙两种固体物质的溶解度曲线如右图所示。
(1)图中P点的含义是_____。
(2)40℃时,饱和溶液中溶质 的质量分数:甲_____乙
的质量分数:甲_____乙
(填“>”、“=”或“<”)。20℃时,将50 g乙物
质放入100 g水中,升温至40℃,溶液中溶质和
溶剂的质量比为_____(用最简整数比表示)。
(3)20℃时,进行了如下图所示的实验:
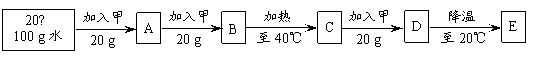
①上述实验过程中属于不饱和溶液的是_____(填序号,下同),溶质的质量分数相同的是_____。
②下列操作能使E中溶液溶质的质量分数发生改变的是_____。
a.加入20 g甲 b.加入100 g水 c.升温至40℃
d.加入150 g 40℃时甲的饱和溶液,再恢复至20℃
27.(6分)在宏观、微观和符号之间建立联系是化学学习的特点。
 (1)下列示意图表示的粒子中,属于阴离子的是_____(填序号,下同);属于同种元素的是_____。
(1)下列示意图表示的粒子中,属于阴离子的是_____(填序号,下同);属于同种元素的是_____。
A. B. C. D.
 (2)比较下列两种变化:①水加热变成水蒸气;②水通电生成氢气和氧气。从微观粒子的角度分析,两种变化的本质区别是_____。
(2)比较下列两种变化:①水加热变成水蒸气;②水通电生成氢气和氧气。从微观粒子的角度分析,两种变化的本质区别是_____。
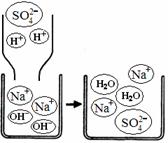
(3)右图是某反应的微观示意图。从微观粒子变化
的角度分析该反应的实质是_____。
若两者恰好完全反应,所得溶液中溶质的质量
分数为10%,则此溶液中钠离子与水分子的
个数比为_____(结果用最简整数比表示)。
26.(6分)化学与生活密切相关。
(1)日常生活中食用的鸡蛋、脱脂奶中富含的营养素是_____。
(2)下列物品所使用的主要材料属于天然纤维的是_____(填序号,下同)。

A.塑料保鲜膜 B.橡胶手套 C.棉布围裙
(3)洗涤剂可清洗餐具上的油污,这是因为洗涤剂具有_____功能。
(4)下列做法应该提倡的是_____。
A.垃圾分类  B.减少使用一次性餐具
B.减少使用一次性餐具
C.使用可降解的塑料袋 D.淘米水浇花
(5)天然气(主要成分为甲烷)是家用燃料。甲烷 在空气中燃烧的化学方程式为_____。
在空气中燃烧的化学方程式为_____。
根据下表数据分析,与煤(按C计)相比,用天然气做燃料的优点是_____。
|
|
1
g物质完全燃烧产生CO2的质量 |
1
g物质完全燃烧放出的热量 |
|
CH4 |
2.75 g |
56
kJ |
|
C |
3.67 g |
32
kJ |
25.0.76 g某物质R与0.96 gO2恰好完全反应,化学方程式为:R + 3O2 XO2 +2SO2。
下列判断正确的是
A.R的相对分子质量为76 g
B.R中一定含有X元素、硫元素,可能含有氧元素
C.生成的XO2和SO2的质量比为11∶32
D.XO2和SO2都是形成酸雨的主要物质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com