
题目列表(包括答案和解析)
26.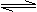 已知反应:3I-(aq)+S2O82-(aq) I3-(aq)+2SO42-(aq);
已知反应:3I-(aq)+S2O82-(aq) I3-(aq)+2SO42-(aq);
 (1)写出反应的平衡常数表达式K=
。
(1)写出反应的平衡常数表达式K=
。
(2)右图表示反应过程中有关物质的能量,则反应的△H 0(填>、<、=)。
(I)、(II)两线中,使用催化剂的是 线。
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 。
(4)反应的速率 可以用I3-与加入的淀粉溶液反应是蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:K^S*
可以用I3-与加入的淀粉溶液反应是蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:K^S*
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.160 |
|
c(S2O82-/mol·L-1) |
0.040 |
0.040 |
0.080 |
0.080 |
0.040 |
|
t/s |
88 |
44 |
22 |
11 |
t1 |
则:该实验的目的是
显色时间t1= s
分析表中数据,得出的结论是
25. 下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示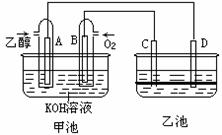 回答下列问题:
回答下列问题:
(1)通入乙醇的惰性电极的电极反应式为 。
(2)在乙池反应过程中,可以观察到 电极(填“C”或“D”)周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色, C极发生的电极反应式为 。
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应 的热化学方程式为
的热化学方程式为

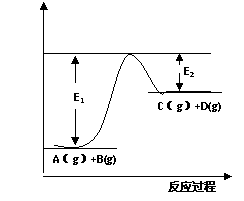
24. 反应A(g)+B(g)  C(g) +D(g)
C(g) +D(g)
过程中的能量变化如图所示,回答下列问题
(1)该反应是__________反应(填“吸热”“放热”);
(2)反应体系中加入催化剂对
反应热是否有影响_______________(填“有”或“无”)。
(3)在反应体 系中加入催化剂,反应速率增大,E1和E2的变化是:
系中加入催化剂,反应速率增大,E1和E2的变化是:
E1________,E2________(填“增大”“减小”“不变”) 。
23. 在密闭容器中进行下列反应 CO2(g) + C(s) 2CO(g) △H >0 达到平衡后,改变下列条件,分析指定物质的浓度及平衡如何变化:
2CO(g) △H >0 达到平衡后,改变下列条件,分析指定物质的浓度及平衡如何变化:
(1)增加C的量 ,平衡______________(填“向正反应方向移动”或“向逆反应方向移动”或“不移动” ;下同),c(CO)_______ (填“增大”或“减小”或“不变”;下同)
(2)减小密闭容器的体积,保持温度不变, 则平衡_____________, c(CO2)________。
(3)通入N2,保持密闭容器体积和温度不变, 则平衡___________, c(CO2)________。

 (4)保持密闭容器体积不变,升高温度, 则平衡______________, c(CO)_________。
(4)保持密闭容器体积不变,升高温度, 则平衡______________, c(CO)_________。
22.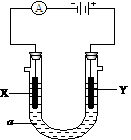 电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,
同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电
极反应式是 。
②Y电极上的电极反应式是  。
。
⑵如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是
②Y电极的材料是 ,电极反应式是
(说明:杂质发生的电极反应不必写出)K^S*
③假若电路中有0.1摩尔电子通过时,阴极增重 克。
21. 高炉炼铁中发生的基本反应如下: FeO(s)+CO(g)  Fe(s)+CO2(g)(正反应为吸热反应),已知1100℃时,K=0.263。
Fe(s)+CO2(g)(正反应为吸热反应),已知1100℃时,K=0.263。
(1) 其平衡常数表达式为: K=
温度升高,化学平衡发生移动后达到新的平衡状态,高炉内CO2和CO的体积比值________(填“增大”“减小”或“不变”),平衡常数K的值________(填“增大”“减小”或“不变”) 
(2)1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态_______(填“是”或“否”),此时化学反应速率是V正____
V逆(填“大于”、“小于”或“等于”),其原因是
 。
。
20. 被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过 ”水和氧化锌组成的电解液。电池总反应为:
Zn + 2 MnO2+H2O = ZnO + 2MnO(OH)2。下列说法正确的是( )
”水和氧化锌组成的电解液。电池总反应为:
Zn + 2 MnO2+H2O = ZnO + 2MnO(OH)2。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当 0.l mol Zn 完全溶解时,流经电解液的电子个数为1.204×l023
D.电池正极反应式为:2MnO2 + 2e-+ 2H2O = 2MnO (OH)2十2OH-
第Ⅱ卷(非选择题,共90分)
19. 蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是( )
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
18.下列说法正确的是 ( )
(1)增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(2)增加水的量或温度,可以加快镁跟水的反应速率。
(3)对于反应CaCO3(s)  CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对反应3H2(g)
+ N2(g)  2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,但化学反应速率不变
2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,但化学反应速率不变
A.(4) B.(1) (4) C.(1) (2) (3) D. (1) (2)
17.2H2(g)+O2(g)==== 2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g) ==== CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),若实验测得反应放热3 695 kJ。则原混合气体中H2与CH4的物质的量之比是( )
A.1∶1 B.1∶3 C.1∶4 D.2∶3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com