
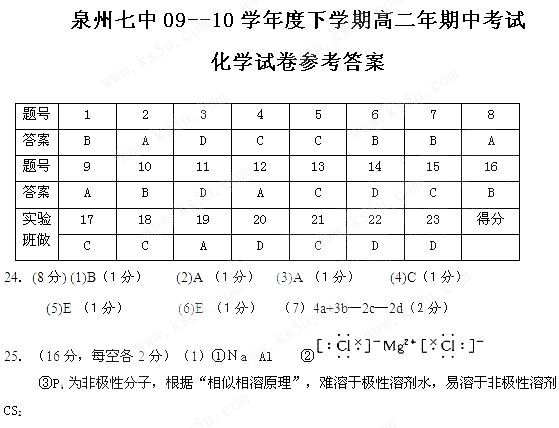
题目列表(包括答案和解析)
1.下述做法能改善空气质量的是
A.以煤等燃料作为主要生活燃料
B.利用太阳能、风能和氢能等能源替代化石能源
C.鼓励私人购买和使用汽车代替公交车
D.限制使用电动车
27.(14分)⑴ 1s22s22p63s23p4(2分)K^S*5U.C#O
⑵ 高(1分) 因为A的氢化物分子间存在氢键(2分)
⑶+2(1分) K4[D(CN)6]=4K++[Fe(CN)6]4-(2分) K3[Fe(CN)6] (2分)
⑷ ②(2分) 3 (2分)
26.(16分)(1)H2O2的电子式(2分) 3d54s1 (2分) (2)分子晶体(2分)
(3)Al>F;(1分)三角锥形 ,(1分) CO2(或CS2、N2O、BeCl2)(2分)
(4)非极性(1分) BrCl (2分) (5)d(1分) 2∶3(或8∶12)(2分)
27.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子K^S*5U.C#O |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
正三价阳离子的核外电子排布为[Ar]3d5 |
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
⑶D元素的某价态阳离子可与KCN溶液形成一种俗称黄血盐的配合物甲,甲的化学式可表示为K4[D(CN)6],则中心原子D的化合价为 ,甲在水溶液中的电离方程式为 ;已知D元素的另一种价态的离子可与KCN溶液形成另一种配合物乙,乙的配位数与甲相同,则乙的化学式为 。
 ⑷下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
⑷下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
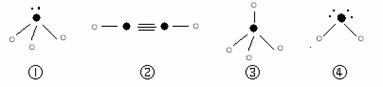
则在以上分子中,中心原子没有采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键。高◎考※资*源
 (2)①铬
O=C=O ②H2CO3<H2SO4
③S>C>O
(2)①铬
O=C=O ②H2CO3<H2SO4
③S>C>O
26.(16分)下表为长式周期表的一部分,其中的编号代表对应的元素
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
③ |
④ |
⑤ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑥ |
|
|
⑧ |
⑦ |
|
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
⑾ |
|
试填空
(1)写出①、④两元素按原子个数比为1:1形成的化合物的电子式 ;写出上表中元素⑨原子的外围电子排布式 ;
(2)元素②与⑦形成的化合物的晶体类型是:_ _ _;
(3)元素⑤、⑥的第一电离能大小顺序是: > (用元素符号表示);元素③与元素①形成的X分子的空间构型为:
。请写出一种与N3-互为等电子体的分子的化学式

(4)⑦、⑧两种元素能形成一种AB2型的共价分子,该分子属于 分子(填“极性”或“非极性”)⑤、⑦、 ⑾三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素的单质。请写出⑦、⑾两种元素形成的互化物的化学式 (正价元素写在前面)。
(5)元素⑩在元素周期表分区中属于 区元素,元素⑩在一定条件下形成的晶体的两种晶胞如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为: 。

25.(16分)(1)A、B、C、D、E六种短周期元素的原子序数依次增大。已知A、C、E三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的次外层电子数比最外层电子数多3个
试回答:
①写出下列元素的符号A___________,C___________;
②用电子式表示B、E形成的化合物___________;
③D的一种单质D4难溶于水,易溶于CS2,请解释原因 。
(2)X、Y、Z、W四种前四周期元素的原子序数依次递增。X元素属于非金属,且X原子核外各能级上的电子数相等;Y原子核外的p电子数比X原子核外的p电子数多2个,Z原子核外最外层的p电子是最外层的s电子的2倍,W元素的基态原子在前四周期中未成对电子数最多
试回答:
①写出W元素的名称_______,X、Y两元素形成的非极性分子的结构式___________
②X、Z元素的最高价氧化物对应水化物的酸性强弱为 < (用化学式表示)。
③X、Y、Z这三种元素原子半径的大小为 > > (填元素符号)
24.(8分) 现有下列晶体, 请按要求回答相应问题。(前六个小题用编号填空)
A.干冰 B.晶体硅 C.氩 D.二氧化硅 E.氯化铵
(1)通过非极性键形成的晶体是 。
(2)属于非电解质且熔化时只需破坏分子间作用力的是 。
(3)属于分子晶体,且分子为直线型结构的是 。
(4)不含任何化学键的晶体是 。
(5)固态时不导电,熔融状态下能导电的是 。
(6)含有离子键、共价键、配位键的化合物是 。
(7)已知石墨在一定条件下可将D还原成B,反应方程式为SiO2+2C======Si+2CO,若石墨中C-C的键能为a,SiO2中Si-O的键能为b,晶体硅中Si-Si的键能为c,CO的键能为d,请用a、b、c、d表示生成晶体硅时的反应热△H= 。K^S*5U.C#O
23.在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是( )。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
第Ⅱ卷(非选择题,共54分)
22.共价键的断裂有均裂和异裂两种方式,即均裂:A∶B → A·+B· ;异裂:A∶B → A++[∶B]-。下列化学反应中发生共价键均裂的是( )
A.2K+2H2O=2KOH+H2↑
B.2Na+2C2H5OH → 2C2H5ONa+H2↑
C.Na2CO3+H2O NaHCO3+NaOH
NaHCO3+NaOH
D.CH3COOH+C2H5OH 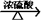 H2O+CH3COOC2H5
H2O+CH3COOC2H5
21.对于SO2和CO2的说法中正确的是( )
A.都是直线形结构 B.中心原子都采用SP杂化轨道
C.SO2为V形结构,CO2为直线形结构 D.S原子和C原子上都没有孤对电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com