
题目列表(包括答案和解析)
5.金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- = Ni
B.电解后,电解槽底部的阳极泥中只有Cu和Pt
C.电解后,溶液中存在的阳离子只有Fe2+ 和Zn2+
D.电解过程中,阳极质量的减少与阴极质量的增加相等
4、能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是 ( )
A.向水中投入一小块金属钠 . B.将水加热煮沸.
C.向水中通入二氧化碳气体. D.向水中加食盐晶体
3.有“0”刻度且可用于测量液体体积的仪器是 ( )
A.滴定管 B.容量瓶 C.量筒 D.托盘天平
2.下列物质的水溶液能导电,但属于非电解质的是
A.CH3COOH B.Cl2 C.NH4HCO3 D.SO2
1. 在医院中,为酸中毒病人输液不应采用
A. 0.9%氯化钠溶液 B. 0.9%氯化铵溶液
C. 1.25%碳酸氢钠溶液 D. 5%葡萄糖溶液
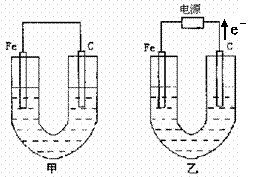
29.(15分)、如图所示,甲、乙两池电极材料都是铁棒与碳棒,乙池中电子电子流动方向见图,回答下列问题:
(1)若两池中均盛200mL饱和NaCl溶液和酚酞的混合液,反应开始后:
①甲池中 极,乙池中的
极附近溶液变红(填“正”或“负”或“阴”或“阳”)。
②甲池碳极上电极反应式是
乙池中Fe电极上反应式为 。
③若乙池中收集到1.12L(标况下)有色气体时,停止实验,忽略池中溶液体积的变化,则池中溶液的c(OH-)约为
,要使溶液恢复到电解前的相同的状况,应向溶液中补充一定量的

A.盐酸 B. NaCl固体 C. NaCl溶液 D. HCl气体
(2)若两池中均盛有200mL 2mol•L-1CuSO4溶液:¥高#考#资%源*网
①反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②写出乙池通电时总反应的离子方程式: 。
③若乙池中通过1.2mol 电子后停止实验,则乙池中共可收集到气
体的体积为 (标准状况下)
福州八中2009-2010学年第二学期期中考试
28.(10分)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g) + B(g)  xC (g) + D(s)C500。5s时,测得A的物质的量为1.7mol,C的反应速率为0.045mol·L-1·s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC (g) + D(s)C500。5s时,测得A的物质的量为1.7mol,C的反应速率为0.045mol·L-1·s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x = 。
(2)从反应开始到40s达平衡状态,A的平均反应速率为 。
(3)平衡时容器中B的体积分数为 。
(4)该温度下此反应的平衡常数为 。
(5)下列各项能表示该反应达到平衡状态的是 。
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
27.(15分)现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。F的水溶液为浅绿色。物质D的焰色为黄色

回答下列问题:
(1)写出下列物质的化学式:A 、丙
(2)写出下列反应离子方程式:
反应③
反应⑤
(3)写出G溶液与金属 C反应的离子方程式 。
若该方程式是一套原电池装置的总反应式,则该原电池负极反应式为 ,正极反应式为: 。
(4)描述F溶液中滴加D溶液后的现象 ,写出最后生成H的化学方程式 。
26.(10分)
(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反
应的热化学方程式 ;
已知:3Fe (s)+2O2(g)== Fe3O4(s) △H=-1118.4kJ• mol-1,根据以上信息,则反应 3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g) 的△H= ,该反应达平衡时,化学平衡常数表达式K= 。
(2)某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定
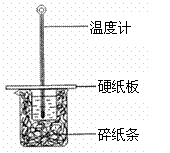 ①图中装置缺少的一种仪器,该仪器名称为
。
①图中装置缺少的一种仪器,该仪器名称为
。
②将反应混合液的 温度记为反应的终止温度。
③下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯K^S*5U.C#
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
23.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通甲烷和氧气,其总反应式为:CH4 +2O2+ 2OH-= CO32- + 2H2O,有关此电池的推断正确的是
A.电解质溶液中CO32-向正极移动
B.工作一段时间后,正极附近溶液的pH降低
C.负极的电极反应式为:CH4+10OH--8e- == CO32-+6H2O
D.标准状况下,通入5.6LO2完全反应后,有0.50mol电子转移
|
(CH3COCH3+Br2-→CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据。分析实验数据所得出的结论不正确的是
|
实验 序号 |
初始浓度c/mol•L-1 K^S*5U.C# |
溴颜色消失 所需时间t/s |
||
|
CH3COCH3 |
HCl |
Br2 |
||
|
① |
0.80 |
0.20 |
0.0010 |
290 |
|
② |
1.60 |
0.20 |
0.0010 |
145 |
|
③ |
0.80 |
0.40 |
0.0010 |
145 |
|
④ |
0.80 |
0.20 |
0.0020 |
580 |
A.增大c(CH3COCH3),v(Br2)增大 B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大 D.增大c(Br2),v(Br2)增大
 25.H2SO4、Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入的NaOH体积V之间的关系如图所示,则原混合溶液中Al3+、Mg2+和SO42-的物质的量之比为
25.H2SO4、Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入的NaOH体积V之间的关系如图所示,则原混合溶液中Al3+、Mg2+和SO42-的物质的量之比为
A.1∶1∶1 B.5∶3∶2 C.2∶1∶5 D.3∶2∶2
第Ⅱ卷(共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com