
题目列表(包括答案和解析)
6.生活离不开化学,下列认识错误的是
A.氦气可用于填充安全气球
B.用硬水洗涤衣物,既浪费肥皂,也不易洗干净衣物
C.用洗涤剂除油污是因为洗涤剂能将油污溶解,形成溶液
D.在管道煤气中添加微量难闻的气体是为了及时发现煤气泄漏
5.下列实验现象描述不正确的是
A.红磷在空气中燃烧,产生大量白烟
B.木炭在氧气中燃烧,发出白光,生成黑色固体
C.细铁丝在纯氧气中燃烧,火星四射,生成黑色固体
D.在空气中加热铜片,铜片表面有黑色固体生成
4.下列图示的各物质(或元素)相对含量错误的是

3.日本福岛核泄漏危机发生后,世界多个国家都不同程度检测到微量的放射性元素碘-131。在元素周期表中,碘元素的某些信息如图所示,下列说法不正确的是
 A.碘元素属于金属元素
A.碘元素属于金属元素
B.碘元素原子的核电荷数为53
C.碘元素原子的核外电子数为53
D.碘元素的相对原子质量为126.9
2.下列关于溶液的说法正确的是( )
A. 溶液都是无色的 B. 溶液一定是混合物
C. 稀溶液一定是不饱和溶液 D. 均一、稳定的液体一定是溶液
1.下列描述物质的变化中,不属于化学变化的是

A.硫在氧气里燃烧 B.大米霉变 C.盐酸腐蚀大理石 D.玻璃刀划开玻璃
29.(13分)氢氧化钠固体及溶液在空气中很容易发生变质生成碳酸钠。
(1)甲同学在实验室里发现一瓶敞口放置的氢氧化钠溶液,对其变质情况进行了如下探究。
[猜想与假设]该氢氧化钠溶液已部分变质。
[实验与结论]
|
实验步骤 |
实验现象 |
实验结论 |
|
a.取少量该溶液于一支试管中,加入 ▲ |
▲
|
该氢氧化钠溶液已变质 |
|
b.将步骤a所得的液体静置,取上层清液于另一支试管中,滴加 ▲ |
▲
|
该氢氧化钠溶液已部分变质 |
[拓展探究]甲同学又尝试通过实验除去该氢氧化钠溶液中含有的碳酸钠,方案如下:
向该溶液中加入 ▲ ,充分反应后,经 ▲ 操作,即可除去该氢氧化钠溶液中含有的杂质。
(2)乙同学在实验室里发现少量部分变质的氢氧化钠固体,尝试通过实验测定其中碳酸钠的质量分数。
[设计和进行实验]乙同学设计了下图所示的实验装置(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物)。取10.0g待测样品,进行实验。
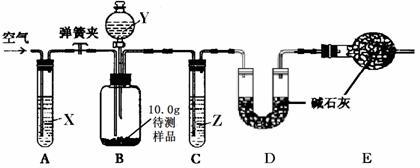
实验步骤如下:
a.连接好装置,并检查气密性;
b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g;
d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气;
f.再次称量装置D的质量为84.5g。
[交流讨论]
①试剂X、Y、Z依次最适宜选用 ▲ (选填字母)。
A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是 ▲ 。
③若没有装置C,则会导致测定结果 ▲ (选填“偏大”、“偏小”或“无影响”,下同);若没有装置E,则会导致测定结果 ▲ 。
[数据处理]根据实验中测得的有关数据,计算部分变质的氢氧化钠固体中碳酸钠的质量分数。
(请写出计算过程)▲
28.(7分)硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂。以下是由废铜料(含铁)生产硫酸铜晶体的流程。

(1)反应①的化学方程式为 ▲ 。
(2)途径I中,反应②、③的化学方程式分别为② ▲ ,③ ▲ ;途径Ⅱ中,反应④的化学方程式为Cu+2H2SO4(浓) △ CuSO4+ SO2↑+2H2O。从环保和经济的角度分析,利用途径 ▲ (选填“I”或“Ⅱ”)制取硫酸铜的方案更合理。
(3)某化学兴趣小组同学用足量铜与10g质量分数为98%的浓硫酸在加热条件下充分反应,生成SO2的质量应 ▲ (选填字母)。
A.等于3.2g B.小于3.2g C.大于3.2g
(4)该化学兴趣小组同学通过查阅资料,发现大多数金属与浓硫酸都能发生反应。现取足量锌与浓硫酸反应,其化学方程式为:Zn+2H2SO4(浓)=== ZnSO4+SO2↑+2H2O。反应一段时间后,老师指出除了SO2,还可能生成另一种气体。请你根据锌的化学性质,推断此气体可能是
▲ ,理由是 ▲ 。
27.(6分)硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进行提纯的流程如下:

(1)滤渣中两种主要成分的化学式为 ▲ 、 ▲ 。
 (2)NaOH和Na2CO3如果添加过量了,可加入适量 ▲ 溶液除去。
(2)NaOH和Na2CO3如果添加过量了,可加入适量 ▲ 溶液除去。
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至 ▲ (选填字母)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
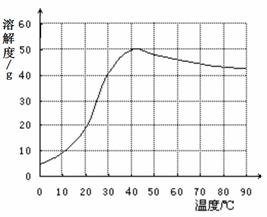
(4)已知硫酸钠的溶解度随温度变化的曲线如右图所示。40℃时,硫酸钠的饱和溶液中溶质质量分数为 ▲ (结果精确到0.1%),将该饱和溶液升高温度至90℃,观察到的现象是 ▲ 。
26.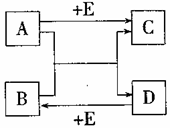 (5分)A、B、C、D、E均为初中化学常见的物质,它们的转化关系如右图所示,部分生成物及反应条件已略去。
(5分)A、B、C、D、E均为初中化学常见的物质,它们的转化关系如右图所示,部分生成物及反应条件已略去。
(1)如果A、B均为黑色固体,C是造成温室效应的主要气体,则E的化学式是 ▲ , A与B反应的化学方程式可能是
▲ ,D由 ▲ 构成(选填“分子”、“原子”或“离子”)。
(2)如果A常用来中和土壤的酸性,C是一种常见的建筑材料,A溶液与B溶液反应的现象是 ▲ , D与E反应的化学方程式可能是
▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com