
题目列表(包括答案和解析)
28.(1)
(2).4.4-二甲基-2-戊烯 4.4-二甲基-1-戊烯
31. 下表为元素周期表的一部分。请回答下列问题:
下表为元素周期表的一部分。请回答下列问题:
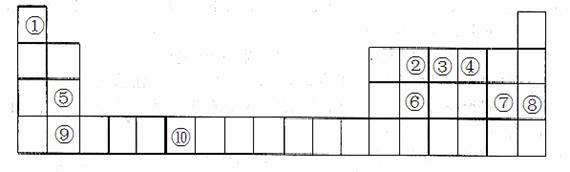 (1)上述元素中,属于s区的是________________________(填元素符号)。
(1)上述元素中,属于s区的是________________________(填元素符号)。
(2)写出元素⑩的基态原子的电子排布式___________________________。
(3)元素第一电离能为⑤________________________⑨(填“大于”或“小于”)。
 (4)元素③气态氢化物的中心原子有________________________对弧对电子,其VSEPR模型为________________________;中心原子的杂化类型为_______________;该分子为_________________分子(填“极性”或“非极性”)。向AgNO3溶液中逐滴加入其水溶液,可观察到的现象为_____________
___________。
(4)元素③气态氢化物的中心原子有________________________对弧对电子,其VSEPR模型为________________________;中心原子的杂化类型为_______________;该分子为_________________分子(填“极性”或“非极性”)。向AgNO3溶液中逐滴加入其水溶液,可观察到的现象为_____________
___________。
(5)元素⑦的钠盐晶胞结构如图所示,每个Na+周围与之距离最近的Na+的个数为________________________。若设该晶胞的棱长为a cm,阿伏加德罗常数的值为NA,则该钠盐的密度为________________________(写出计算式)。
|
30. A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A ______ B_______ C _____ D ________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)A、B、C最高价氧化物的晶体类型是分别是______晶体、______晶体、______晶体
(7)画出D的核外电子排布图_____________________________________,这样排布遵循了____________原理和____________规则。
 (8)用电子式表示B的硫化物的形成过程:___________________________
(8)用电子式表示B的硫化物的形成过程:___________________________
29.在HF、H2O、NH3、CH4、N2、CO2、HI分子中:
(1)以非极性键结合的非极性分子是 。
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥结构的极性分子是 。
(4)以极性键相结合,具有V结构的极性分子是 。
(5)以极性键相结合,而且分子极性最大的是 。
28.(1)写出C5H12所有同分异构体
(2)某烯烃与氢气加成后得到2.2-二甲基戊烷,该烯烃的名称是
27.下列物质属于等电子体的是
A.CH4和NH4+ B.B3H6N3和C6H6
C.CO2、NO2 D.H2O和CH4
26.有下列两组命题
|
A组 |
B组 |
|
Ⅰ、H-I键键能大于H-Cl键键能 |
①HI比HCl稳定 |
|
Ⅱ、H-I键键能小于H-Cl键键能 |
②HCl比HI稳定 |
|
Ⅲ、HI分子间作用力大于HCl分子间作用力 |
③HI沸点比HCl高 |
|
Ⅳ、HI分子间作用力大于HCl分子间作用力 |
④HI沸点比HCl低 |
B组命题正确且能用A组命题加以正确解释的是
A.Ⅰ① B.Ⅱ② C.Ⅲ③ D.Ⅳ④
25.原子序数小于18的元素X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是
A.XO3- B.XO32- C.XO42- D.XO43-
24.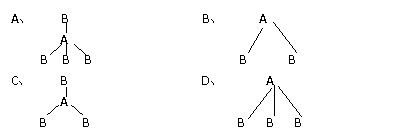 两种非金属元素A、B所形成的下列分子中属于非极性分子的是
两种非金属元素A、B所形成的下列分子中属于非极性分子的是
23.下列说法中正确的是
A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构;
B.P4和CH4都是正四面体分子且键角都为109o28ˊ;
C.NaCl晶体中与每个Na+距离相等且最近的Cl-共有12个;
D.单质的晶体中一定不存在的微粒是阴离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com