
题目列表(包括答案和解析)
4.设阿伏加德罗常数为NA,则下列说法正确的是
A.15g甲基(-CH3)所含有的电子数是10NA
B.常温常压下,4g甲烷所含有的原子数目为NA
C.标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA
D.常温常压下,1mol丙烷所含有的共价键数目为10NA
3.按照系统命名法,下列有机物命名正确的是
A.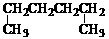 1,4-二甲基丁烷 B.
1,4-二甲基丁烷 B.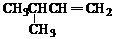 3-甲基丁烯
3-甲基丁烯
C. 2-甲基丁烷 D.
2-甲基丁烷 D.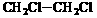 二氯乙烷 [来
二氯乙烷 [来
2.下列说法中错误的是
 A.C2H6和C4H10一定是同系物
A.C2H6和C4H10一定是同系物
B.在相同条件下,燃烧等质量的苯和苯乙烯,消耗O2体积相同
C.相对分子质量相同的两种物质一定是同分异构体
D.单烯烃各同系物中碳的质量分数都相等
1.2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料。下列关于聚乙炔的叙述错误的是
A.聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B.聚乙炔的化学式为 ,其分子中所有碳原子不可能在同一直线上
,其分子中所有碳原子不可能在同一直线上
C.聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D.聚乙炔树脂不加任何填充物即可成为电的良导体
23.(共8分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) K^S*
(1)A、B、C的第一电离能由小到大的顺序为
。
(2)B的氢化物的分子空间构型是
。其中心原子采取
杂化 (3)写出化合物AC2的电子式
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为
。
(4)ECl3形成的配合物的化学式为
。
(3)写出化合物AC2的电子式
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为
。
(4)ECl3形成的配合物的化学式为
。
2009-2010年安溪一中、养正中学高二(下)期中联考化学试题
22. (11分)规有A、B、C、D、E、F六种物质或粒子,
(11分)规有A、B、C、D、E、F六种物质或粒子,
其中A、B、C、D都具有如右图所示的结构或结构单元 ●表示x原子
(图中正四面体以外可能有的部分未画出,虚线不表示 O表示Y原子
化学键或分子问作用力,X、Y可以相同也可以不同) 。
A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态
⑴写出单质A的同素异形体与B物质发生置换反应的化学方程式:
。与A同主族的第4周期元素基态原子的电子排布式为 。
⑵上述六种物质或粒子中互为等电子体的是 (写出化学式)。
⑶F分子的中心原子杂化类型是 。E易溶于F,其原因是
。
21.(8分)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
⑴ 钛有4822Ti和5022Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;按电子排布Ti元素在元素周期表分区中属于
 (填s、P、d、ds或f)区元素
(填s、P、d、ds或f)区元素
⑵ 偏钛酸钡在小型变压器、话筒和扩音器中都有 ● Ti
应用。偏钛酸钡为离子晶体,晶胞的结构如右图 。Ba
所示,它的化学式是 。 O O
⑶ 现有含Ti3+的配合物,化学式为TiCl3(H2O)6,将
1 mol该物质溶于水,加入足量硝酸银溶液,立即沉淀的氯化银为l mol,已知该配合物的配位数为6,则该配合物的配位体是 。1 mol该配合物外界所含结晶水的物质的量为 mol。 K^S*
20.(共13分)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大 请回答下列问题: K^S*
请回答下列问题: K^S*
⑴ X、Y的元素符号依次为 、 ; ⑵ XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理 ;
⑶ Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ; ⑷用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
19.(共6分)在下列物质中:①NaOH、②H2O2、③(NH4)2S、④Na2O2、⑤C2H2、
⑥SiC晶体 ⑦Na2S ⑧单晶硅。(用序号填空)
⑴ 其中含有极性共价键的原子晶体是 ;
⑵ 其中只含有离子键的离子晶体是 ;
⑶ 其中既含有离子键又含有非极性共价键的离子晶体是 ;
⑷ 其中既含有离子键,又含有极性共价键和配位键的离子晶体是 ;
⑸其中含有极性共价键和非极性共价键的非极性分子是 ;
⑹其中含有极性共价键和非极性共价键的极性分子是 。 K^S*
18.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B. 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C. [Cu(NH3)4] 2+的空间构型为正四面体型
D. 在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
第Ⅱ卷(非选择题共46分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com