
题目列表(包括答案和解析)
4、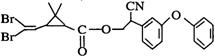 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊醋的结构简式如右图:下列对该化合物叙述正确的是
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊醋的结构简式如右图:下列对该化合物叙述正确的是
A.属于芳香烃 B.属于卤代烃
C.在一定条件下可以发生加成反应
D.在酸性条件下不水解
3、 按系统命名法, CH3-CH2-C-C-H 的正确的名称是
A、3,3-二甲基-4-乙基戊烷 B、3,3-二甲基-2-乙基戊烷
C、3,4,4-三甲基己烷 D、3,3,4-三甲基己烷
2、下列认识中正确的是
A.糖类是有甜味的物质 B.糖类组成一定符合通式Cm(H2O)n
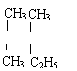 C.糖类是人类维持生命的六大类营养素之一 D.符合通式Cm(H2O)n的一定是糖
C.糖类是人类维持生命的六大类营养素之一 D.符合通式Cm(H2O)n的一定是糖
1.诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是 A 纤维素、脂肪 B 蛋白质、高级烃 C 淀粉、油脂 D 蛋白质、硬化油
19.(16分)
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
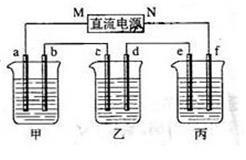
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上的电极反应式为 ;生成的气体在标准状态下的体积: ;
③乙池中反应的离子方程式: ;电极c的质量变化是 g;
④电解后甲溶液PH (填增大、减小或不变);简述其原因: 。
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
, 。
20(14分)Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn ③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z 的外围电子排布式是 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的化合物是 。
(7)由R与X能形成RX3-离子,该离子中心原子的杂化类型为 ,其空间构型为 , 上述原子中能形成与RX3-离子互为等电子体的微粒有 。
18.(9分)
(1)2009年10月16日第十一届全运会在济南举行,在全运会上使用的火炬的燃料是丙烷(C3H8)。已知11g丙烷完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式 ;
(2)已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式: Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1 Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式: _________________
17.(13分)下表是元素周期表的一部分。表中所列字母分别代表某一化学元素。
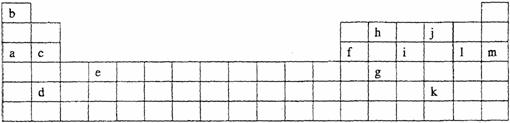
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
①甲是 乙是 (填元素符号)
②甲元素与硫元素相比较,非金属性较强的是 (填名称)
(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:1.原子核对核外电子的吸引力 2.形成稳定结构的倾向 。 下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
|
锂 |
X |
Y[ |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量: 。
②表中X可能为以上13种元素中的 (填写元素符号)元素。X和j形成的化合物有 和 (填化学式)。
③Y是周期表中 族元素(填族序数)。
④以上13种元素中, (填写元素符号)元素原子失去核外第一个电子需要的能量最多。
16.(10分)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为: 4Li + 2SOCl2 =4LiCl + S + SO2。
请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少
量水滴到SOCl2中,实验现象是 ,
该反应的化学方程式为 ;
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
15. (10分)在一个固定体积为2升的密闭容器中,充入2 mol A和1 mol B,发生如下反应:
2A(g) + B(g) 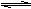 3C(g) + D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g) + D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
(1)写出该反应平衡常数的表达式 ,
2分钟内B 的平均反应速率为
(2)若使容器温度升高,平衡时混合气体的密度减小,
则正反应为 (填“吸热”或“放热”)反应。
(3)若将容器体积缩小至1L,反应达到平衡时C的浓度为 mol/L,
平衡常数 (填“增大”、“减小”或“不变”)。
14.已知磷酸分子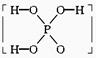 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出H3PO2的分子结构是
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出H3PO2的分子结构是

Ⅱ卷(非选择题,共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com