
题目列表(包括答案和解析)
8.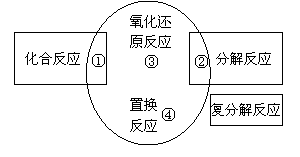 化学反应前后物质所含元素化合价发生变化的反应叫做氧化还原反应。如下图所示各区所列错误的一项是( )
化学反应前后物质所含元素化合价发生变化的反应叫做氧化还原反应。如下图所示各区所列错误的一项是( )
A.③:Ba(OH)2+H2SO4=BaSO4↓+2H2O
B.②2H2O=通电=2H2↑+O2↑
C.①:S+O2=点燃=SO2
D.④:Fe+H2SO4=FeSO4+H2↑
7.在在化学反应A2+BC=B+A2C中,反应物BC与生成物B的质量关系如右图所示。将
2gA2与80gBC恰好完全反应,则生成A2C的质量是( )
A.64g B.18g
C.80g D.9g
6.要除去下列四种物质中的少量杂质(括号内物质为杂质)
甲:CaCO3(Na2SO4) 乙:CaO(CaCO3) 丙:KCl(KHCO3) 丁:炭粉(CuO)
可使用的试剂和操作方法有:①加适量盐酸,搅拌,过滤,洗涤,干燥;②加适量水,搅拌,过滤,洗涤,干燥;③加适量盐酸,蒸发;④加适量水,搅拌,过滤,蒸发;下列组合正确的是:( )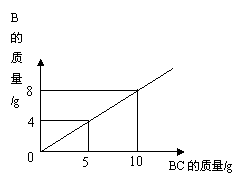
A.甲-② 乙-④ B.丁-① 丙-③ C.丙-① 丁-② D.乙-③ 丙-①
5.下列有关说法中,正确的是( )
①由同种元素组成的物质可能是单质 ②用碳酸氢钠可做焙制糕点的发酵粉
③在原子中,核内质子数一定等于核外电子数 ④用熟石灰可改良碱性土壤
A.①②④ B.①②③ C.②③④ D.①②③④
4. 加“硒”食盐中添加有亚硒酸钠(Na2SeO3),亚硒酸钠能消除加速人体衰老的活性氧,下列说法中正确的是:( )
A Na2SeO3中钠、硒、氧元素的质量比为2:1:3
B该加“硒”食盐中Se(硒)元素的质量分数为40%
C.Na2SeO3属于盐类
D.Na2SeO3中所含元素均为人体中含量较多的元素
3. 最近,“纸火锅”逐渐流行起来。“纸火锅”是用纸张替代金属材料做容器盛放汤料,当酒精燃烧时纸张不会燃烧。对此现象,下列解释合理的是( )
A纸张不是可燃物,不能燃烧
B纸张被水浸湿导致着火点降低
C水蒸发时吸收热量,温度达不到纸张的着火点
D空气不充足,纸张不会燃烧
2. 据报道,“第三代”磁珠圆珠笔问世,该圆珠笔的的球珠由氧化锆瓷材料制成,这种材料的应用使球珠的耐腐蚀性、耐磨性得到了提高。从而填补了国内空白。氧化锆的化学式为ZrO2,在氧化锆中锆元素的化合价为( )
A+2 B+3 C+4 D+5
1.
下列生产过程中主要发生化学变化的是( )
A.太阳能供热 B.石油分馏 C.沼气生产 D.风力发电
30.(14分)Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3 +3NaOH Fe(OH)3↓+3NaCl。由于Fe(OH)2不稳定,在水中只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式: ▲ ,因而在溶液中较难制得纯净的Fe(OH)2 。
[猜想与假设]
若按照常规的正确方法向FeCl2溶液中滴加NaOH溶液,很难观察到白色沉淀现象,只能看到灰绿色沉淀。你认为灰绿色沉淀最可能的成分是 ▲ 。
[设计与实验]
用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含氧气的蒸馏水配置FeSO4溶液与氢氧化钠溶液,然后反应制备。
⑴除去蒸馏水中溶解的氧气,常采用 ▲ 的方法。
⑵先在试管中注入FeSO4溶液后,还要在试管中滴入 ▲ ,然后再考虑加入NaOH溶液,实验更容易获得成功。
⑶生成白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是 ▲ 。
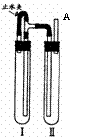 方法二:用右图装置来制备。
方法二:用右图装置来制备。
⑴在装置Ι中加入Fe和稀H2SO4。
⑵在装置Ⅱ中加入NaOH浓溶液。
⑶为了制得白色Fe(OH)2沉淀,在装置Ι和Ⅱ中加入试剂,打开止水夹,塞 紧橡胶塞,反应一段时间后再夹紧止水夹,在夹紧止水夹之前的实验步骤是
▲ ,写出夹紧止水夹后Ⅱ中的化学反应方程式 ▲ 、 ▲ 。
⑷这样生成的Fe(OH)2沉淀能较长时间保持白色,其原因是 ▲ 。
[分析与计算]
将18gFe(OH)2在空气中高温加热到质量不再变化为止,最终得到16g只含有Fe、O元素的剩余固体,请你通过计算来确认该固体的化学式。
[反思与应用]
⑴在化学实验中对于滴管到底能否伸入容器口内部去滴液体你的看法是 ▲ 。
⑵请你提出一个有关化学的常规情况下认为不可以,但改变了条件后却可以打破常规的例子
▲ 。
29.(6分)某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、S约占1.2%。现欲回收铜和锌,并对硫进行环保处理,主要步骤如下图所示:
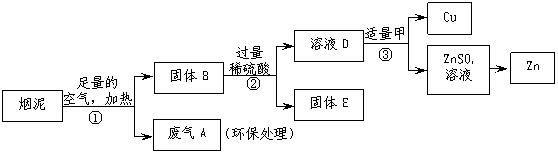
⑴步骤①产生的废气A中,会造成酸雨的是 ▲ 。
⑵步骤②中含铜元素的物质所发生反应的化学方程式是 ▲ 。
⑶步骤③中反应的化学方程式是 ▲ 、 ▲ 。
⑷有人认为若步骤①中空气不足量,会导致锌的回收率降低,你认为是否正确?
▲ (填“正确”或“不正确”),理由是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com