
题目列表(包括答案和解析)
18、恒温恒容下,将2 molA气体和2 molB气体通人体积为2 L的密闭容器中发生如下反应:2A(g)+B(g) x
C(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mo1·L-1。
x
C(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mo1·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 。
(2)x = 。 (3)A的转化率与B的转化率之比为 。
(4)下列各项可作为该反应达到平衡状态的标志的是 。
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分于质量不再变化
D.A的消耗速率与B的消耗速率之比为2∶1
(5)保持温度和容积不变,向平衡体系中再充人2molA和2molB气体,达到新平衡时B的物质的量为 。
(6)欲使反应达到平衡时,C的物质的量分数与上述平衡相等,起始加入A、B的物质的量n(A)和n(B)之间应满足的关系为 。
17、实验室利用右图装置进行中和热的测定,请回答下列问题:
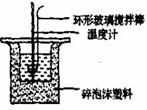 (1)做1次完整的中和热测定实验,温度计需使用 次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?
(1)做1次完整的中和热测定实验,温度计需使用 次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?
⑵某组同学测得的中和热数据为56.5kJ/mol,而课本上的数据为57.3 kJ/mol。如果他们的操作都正确,请你帮他们分析数据偏低可能的原因。(写出两种可能的原因)
16、把3mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+B(g)  xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论错误的是
xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论错误的是
A.A的平均反应速率为0.15mol/(L·min) B.平衡时,C的浓度为0.25mol/L
C.平衡时,B的转化率为20% D.平衡时,容器内压强为原来的0.8倍
15、在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)
 CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0

下
下列分析中不正确的是C
A、图Ⅰ研究的是t0时升高温度对反应速率的影响
B、图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C、图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D、图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
14、一个真空密闭容器中盛有1molPCl5,加热到200℃时发生了反应:PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是
A.M>N B.M=N C.M<N D.无法确定
13、在温度不变下,在恒压容器a与恒容容器b中,分别充入体积比为1∶3的N2和H2。若开始时两容器的体积相等,且在相同条件下达到平衡时,两容器中N2的转化率应当是
A.a中大 B.b中大 C.a、b中一样大 D.无法判断
12、在一密闭容器中,aA(g) bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向正反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数减小了 D.a>b
11、在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g) 2HI(g),已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0. 2 mol·L-1,则平衡时H2的浓度(mol·L-1)是
2HI(g),已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0. 2 mol·L-1,则平衡时H2的浓度(mol·L-1)是
A. 0.32 B. 0.16 C. 0.08 D. 0.04
10、在一定温度不同压强(p1<p2)下,可逆反应2X(g) 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(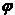 )与反应时间(t)的关系有以下图示,正确的是
)与反应时间(t)的关系有以下图示,正确的是
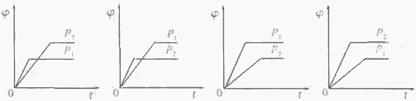
A B C D
9、右图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
 A.
X和Y中只有一种为气态,Z为气态
A.
X和Y中只有一种为气态,Z为气态
B. X、Y、Z均为气态
C. 上述可逆反应的正反应为放热反应
D. 上述反应的逆反应的ΔH>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com