
题目列表(包括答案和解析)
28..(9分)将含有C、H、O的有机物4.08g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过盛有氯化钙的干燥管A和盛有碱石灰的干燥管B。测得A管质量增加了2.16g,B管质量增加了10.56g。已知该有机物的相对分子质量为136。
(1)燃烧此化合物4.08g,需消耗氧气的质量是 g
(2)求此化合物的分子式
(3)根据有机物的性质确定其可能的结构简式:
①若此有机物为芳香族化合物,其苯环上只有一个取代基,该物质能与氢氧化钠溶液反应,则其结构简式可能为(有几种写几种):
②若此有机物能发生银镜反应、且在常温下能与浓溴水发生取代反应,其苯环上有两个取代基,则其结构简式可能为(写一种):
高☆考♂资♀源?网
保定市高二年级第二学期期中联考
27.(10分)用离子方程式表示下列反应:
(1)某可溶性盐的化学式XmYn(是最简结构m≠n),将一定量的该盐溶于足量的水中,若
测得溶液的pH为3,该盐水解的离子方程式可能为 。若测得溶液的
pH为11,则该盐与水反应的离子方程式可能为 。
(2)NH4Cl溶液与Na反应 。
(3)AlCl3溶液与Na2S反应 。
(4)CuSO4溶液与Na2S溶液反应 。
26.(16分)现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
 高☆考♂资♀源?网
高☆考♂资♀源?网
请回答:
(1)A、W的溶液分别加热蒸干并灼烧最后所得固体为 、 。
(2)D溶液pH (填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示) 。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是
。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4):前者 后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是
25.(12分)喷泉是一种常见的自然现象,其产生原因是存在压强差。


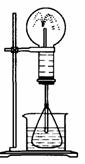
图1 图2
(1)图1为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是________高☆考♂资♀源?网
A. HCl和H2O B. O2和H2O
C. NH3和H2O D. CO2和NaOH
(2)某学生积极思考产生喷泉的其他办法,并设计了如图2所示的装置。
①在图2的锥形瓶内,分别加入足量下列物质,反应后可能产生喷泉的是_______
A. Cu与稀盐酸 B. NaHCO3与NaOH
C. CaCO3与稀硫酸 D. NH4HCO3与稀盐酸
②在图2的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,结果也产生了喷泉,水槽中加入的物质可以是_______
A. 浓硫酸 B. 食盐 C. 硝酸钾 D. 硫酸铜
③比较图1和图2两套装置,从产生喷泉的原理来分析,图1是_______上部烧瓶内气体压强,
图2是_______下部锥形瓶内气体压强(均填“增大”或“减小”)
(3)城市中常见的人造喷泉及火山喷发的原理与上述__________(填“图1”或“图2”)装置的原理相似。
24.(8分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:
A(g)+2B(g)  3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是_____________(用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的
量为 mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数
与原平衡相比 (选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应
混合气中体积分数仍与原平衡相同,则还应加入C mol。
23.(11分)某温度(t℃)时,水的离子积为Kω=1×10-13,则该温度(选填大于、小于或等于)_______25
℃,其理由是_____________________________________。若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是_______________高☆考♂资♀源?网__。
(2)若所得混合液的pH=2,则a∶b=____________。此溶液中各种离子的浓度由大到小排列顺序是_____________ _______。
22.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为: 高☆考♂资♀源?网
4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是 ( )
A.正极反应为:O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
卷Ⅱ (非选择题66分)
21.在测定硫酸铜晶体结晶水含量实验中,下列操作会引起晶体中结晶水的质量分数偏大的是( )
A.加热后在空气中冷却称量
B.粉末未完全变白就停止加热,进行称量计算
C.加热时间过长,部分变黑
D.两次称量结果相差0.2g就不再继续加热而进行计算
20.下列物质中既能与盐酸反应,又能与NaOH溶液反应的是 ( )
①NaHCO3 ② (NH4)2CO3 ③Al(OH)3
④NH4Cl ⑤H2NCH2COOH ⑥CH3COOH
A.①②③ B.①②④⑤ C. ⑤⑥ D.①②③⑤
19.某有机物结构简式为: ,则用Na、NaOH、NaHCO3与等物质的量的该有机物恰好反应时,消耗Na、NaOH、NaHCO3的物质的量之比为 ( )
,则用Na、NaOH、NaHCO3与等物质的量的该有机物恰好反应时,消耗Na、NaOH、NaHCO3的物质的量之比为 ( )
A.3∶3∶2 B.3∶2∶1 C.1∶1∶1 D.3∶2∶2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com