
题目列表(包括答案和解析)
1.近几年自然灾害频发,灾害中常有如下变化发生,属于化学变化的是 ( )
A、冰川融化 B、房屋坍塌 C、森林火灾 D、山体滑坡
32. (6分)2011年3月11日,日本9级大地震导致的福岛核泄漏,主要泄露的物质为碘-131,碘-131一旦被人体吸入会引发低甲状腺素(简称低甲)症状,患者必须长期服用甲状腺素片,而更严重的甚至可能引发甲状腺癌变。服用稳定性碘的确可封闭甲状腺,让放射性碘无法“入侵”,但是过量的稳定性碘会导致碘中毒。对成年人推荐的服用量为每天100mg碘。我国部分地区群众听信谣言,出现抢购现象。如图是某品牌的加碘盐的标签,请回答下列问题。
(6分)2011年3月11日,日本9级大地震导致的福岛核泄漏,主要泄露的物质为碘-131,碘-131一旦被人体吸入会引发低甲状腺素(简称低甲)症状,患者必须长期服用甲状腺素片,而更严重的甚至可能引发甲状腺癌变。服用稳定性碘的确可封闭甲状腺,让放射性碘无法“入侵”,但是过量的稳定性碘会导致碘中毒。对成年人推荐的服用量为每天100mg碘。我国部分地区群众听信谣言,出现抢购现象。如图是某品牌的加碘盐的标签,请回答下列问题。
(1)KIO3中碘的化合价为______________;
(2)下列物品遇到碘水显蓝色的是____________;(填字母序号)
A.白酒 B.米汤 C.牛奶 D.马铃薯片
(3)高温烹饪会使含碘量降低,说明碘酸钾的化学性质之一是____________;
(4)根据有关数据估算,一个成年人,若要通过吃碘盐防止放射性碘的危害,每天至少需要吃____________kg食盐。你认为通过用吃碘盐防止放射性碘的危害能否可行, 为什么? ________________________。
31.(6分)世界各国高度关注并加紧勘探开发的新生代能源--可燃冰将首次纳入到我国能源规划之中。据报道,科学家在深海发现了一种外表象冰的固态物质,这种物质的成分是甲烷水合物(CH4·xH2O),称为可燃冰。通常情况下,这种物质不稳定、易分解、易燃,在低温或高压下呈固态。其储量超过煤和石油的总储量,是很有前途的待开发能源。
(1)请你分析可燃冰作为能源有什么优点? ____________;
(2)试写出甲烷水合物中的主要成分甲烷在空气中燃烧的方程式____________;
(3)科学家对在我国南海海域发现的可燃冰的组分进行研究后,测得其含碳的质量分数 为7.5%,则x的值为____________;
(4)测得这种晶体的结构为平均每46个水分子建8个笼,每个笼中容一个甲烷分子或一个游离的水分子,则在这种晶体中共含____________种分子。若每8个笼容有6个甲烷和2个水分子,则在这8个笼组成的整体中,甲烷与水的分子个数比是___________。
30.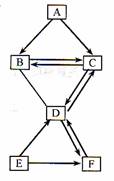 (6分)A、B、C、D、E、F六种物质均由非金属元素组成。C、E是单质,其余四种都是化合物;A、B组成元素相同,D、F组成元素也相同。常温下C、D、F都是气体;E为黑色固体。它们存在如右图的转化关系,“→”表示可以向箭头所指方向一步转化,“-”表示两种物质间可以发生反应。(反应条件与其他物质均已略去)
(6分)A、B、C、D、E、F六种物质均由非金属元素组成。C、E是单质,其余四种都是化合物;A、B组成元素相同,D、F组成元素也相同。常温下C、D、F都是气体;E为黑色固体。它们存在如右图的转化关系,“→”表示可以向箭头所指方向一步转化,“-”表示两种物质间可以发生反应。(反应条件与其他物质均已略去)
请回答下列问题:
(1)写出下列物质的化学式:E:____________;D:____________。
(2)写出实现下列转化的化学方程式。
①D→C:________________________;
②A→B:________________________。
29.(5分)为测定二氧化碳与氢氧化钠反应的产物,某化学学习小组的同学向一定量的NaOH溶液中通入一定量的CO2充分反应后,低温蒸发结晶,得到白色固体,对该白色固体的成分。
[资料卡]当二氧化碳过量时,碳酸钠也会与二氧化碳反应Na2CO3+CO2+H2O=2NaHCO3
Na2CO3+HCl=NaHCO3+NaCl; NaHCO3+HCl=NaCl+H2O+CO2↑;
NaHCO3+NaOH=Na2CO3+H2O; 2NaHCO3 加热 Na2CO3+CO2↑+H2O;
Na2CO3和NaOH的热稳定性都较好。
[猜想与假设]该小组的同学进行了猜测:
(1)甲同学认为该白色固体可能是NaOH与Na2CO3的混合物。你认为该固体还可能是Na2CO3或____________或____________。
[实验设计]
(2)
|
实验操作 |
实验现象 |
结论 |
|
(1)取一定质量的样品,加热 |
固体质量减少 |
一定有
一定无 可能有 |
|
(2)另取样品,向其中滴加稀盐酸 |
有气体产生 |
28.(6分)侯氏制碱法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定用装置已略去)。
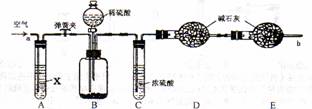
实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放人装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴人稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓人空气数分钟,然后称得干燥管D的总质量为85.6g。
试回答:
(1)气密性检查:先将________________________ (填操作),若看到分液漏斗中的水滴下落几滴后,不再落下,则气密性良好。
(2)鼓入空气的目的是________________________,装置A中试剂X最适宜选用____________。
(3)若没有C装置,则会导致测定实验结果____________ (填“偏大”或“偏小”)。
(4)请根据实验中测得的有关数据,纯碱样品中碳酸钠的质量分数为____________ (结果保留一位小数)。
27. (10分)过氧化钠(Na2O2)是一种黄色固体。某次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入右图烧杯中,缓慢倒人CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时又惊奇的发现棉花燃烧起来。
(10分)过氧化钠(Na2O2)是一种黄色固体。某次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入右图烧杯中,缓慢倒人CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时又惊奇的发现棉花燃烧起来。
I.实验过程中“下位的蜡烛先熄灭,上位的后熄灭”的现象说明二氧化碳具有的性质是______________________。
Ⅱ.棉花为什么会燃烧呢?小组同学联想起物质燃烧的相关知识,推理出棉花要燃烧,除了我们已知“棉花是可燃物”之外,还需满足的条件为_________________________________。
提出问题:在实验中是如何给棉花燃烧提供上述条件的呢?
查阅资料:2Na2O2+2CO2=Na2CO3+O2↑; 2Na2O2+2H2O=4NaOH+O2↑
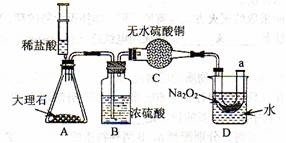
设计实验:经过讨论后,小组同学设计了如下图的实验进行探究。
实验步骤:(1)按上图装配好装置,并检查其气密性;
(2)将相关的试剂放入对应的仪器中;
(3)推动注射器的活塞,把稀盐酸注入锥形瓶内,并固定活塞位置;
A中发生的反应方程式为________________________;
(4)一段时间后,在a处放置一根带火星的小木条,观察现象。
实验现象:(1)C中干燥管中没有出现蓝色
(2)a处带火星的小木条复燃;
(3)D处烧杯中水的温度升高。
实验分析:(1)B装置的作用是____________________;为什么要有此装置____________;
(2)C装置的作用是____________;
(3)D装置的烧杯内水温升高的原因是____________。
实验结论:“小木条复燃”说明了Na2O2和CO2反应产生了氧气并放出热量;满足了棉花燃烧的条件,棉花的主要成分为纤维素,可用(C6Hl0O5)n。来表示,试写出纤维素完全燃烧的方程式________________________。
26.(4分)实验室常用稀盐酸和大理石制取二氧化碳气体。现需收集4瓶(每瓶以125mL计算)二氧化碳气体,问至少需要多少克大理石(含碳酸钙80%)与足量的稀盐酸反应才能制得?(实验条件下二氧化碳的密度为2g·L-1,结果保留一位小数)
25. (6分)某化学兴趣小组,设计了如右图的装置,研究空气中所含氧气的体积,用一个50mL量筒倒扣在水中,使量筒内外液面均位于40mL处。量筒内浮着一个铜制的小船,船中放有足量白磷。现把浓硫酸缓缓倒入水中并搅拌。一会儿,白磷发生自燃,量筒内液面上升,向水槽内加水,至水槽与量筒内液面相平,读出读数。
(6分)某化学兴趣小组,设计了如右图的装置,研究空气中所含氧气的体积,用一个50mL量筒倒扣在水中,使量筒内外液面均位于40mL处。量筒内浮着一个铜制的小船,船中放有足量白磷。现把浓硫酸缓缓倒入水中并搅拌。一会儿,白磷发生自燃,量筒内液面上升,向水槽内加水,至水槽与量筒内液面相平,读出读数。
(1)加入浓硫酸的的原因是________________________;
(2)放白磷的小船用铜做的原因是________________________;
(3)最终,液面大约位于量筒刻度________________________处;
(4)为何要向水槽内加水至内外液面相平________________________;
(5)试评价该兴趣小组的设计在选用仪器上有何缺陷________________________
24.(4分)右下图是A、B、C三种物质的溶解度曲线,根据下图回答下列问题:
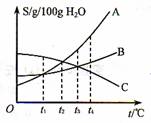 (1)在t5℃时,在三只烧杯中各装入50g水,分别充分溶解A、B、C三种物质,其中溶解最多的物质是____________;
(1)在t5℃时,在三只烧杯中各装入50g水,分别充分溶解A、B、C三种物质,其中溶解最多的物质是____________;
(2)在____________℃时,分别配制A、B两种物质的等质量的饱和溶液,需要用水的质量相等; ’
(3)t4℃时,将A、B、C三种物质的饱和溶液各500g,分别蒸发掉100g水,析出晶体的质量由小到大的顺序是____________;
(4)t4℃时,将A、B、C三种物质的饱和溶液降至t3℃,所得溶液的质量分数由大到小的顺序为____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com