
题目列表(包括答案和解析)
4.某有机物在氧气中充分燃烧,生成等物质的量的二氧化碳和水。则该有机物的组成必须满足的条件是
A.分子中C、H、O的个数比为1:2:3 B.分子中C、H的个数比为1:2
C.该有机物的相对分子质量为14 D.该分子中肯定不含氧
3.按官能团分类,下列说法正确的是
A.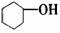 属于芳香化合物 B.
属于芳香化合物 B. 属于羧酸
属于羧酸
C.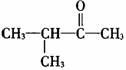 属于醛类 D.
属于醛类 D. 属于酚类
属于酚类
2.大多数有机物分子里的碳原子与碳原子或碳原子与其它原子相结合的化学键是
A.只有极性键 B.只有非极性键
C.有极性键或非极性键 D.有离子键
1.下列物质的电子式正确的是


25. (10分)如下图所示的装置,C、D、E、F
(10分)如下图所示的装置,C、D、E、F
都是惰性电极。将电源接通后,向乙中滴
入酚酞试液.在F极附近显红色。试回答
以下问题:
(1)电极A是 。(填正极或负极)
(2)甲装置中电解反应的总化学方程式是 _________ __________ ____ 。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56mL(标准状况下)气体,电解后溶液体积为500mL时,求所得溶液在25℃时的pH =_______。
(4)欲用丙装置给铜镀银,G应该是 ____ (填“银”或“铜”), 电镀液的主要成分是(填化学式) 。
24.(12分)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,4秒钟后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
用H2O表示的化学反应速率为 。
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”)。
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将
(均填“增大”“减小”或“不变”)。
23.(10分)⑴北京奥运会祥云火炬将中国传
 统文化、奥运精神以及现代高科技融为一
统文化、奥运精神以及现代高科技融为一
体。火炬内熊熊大火来源于丙烷的燃烧,丙
烷是一种优良的燃料。试回答下列问题:
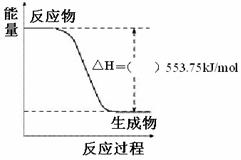
① 右图是一定量丙烷完全燃烧生成
CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“-”。
② 写出表示丙烷燃烧热的热化学方程式:
_______ _____________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_____ __。
⑵盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知: H2O(g)=H2O (l) △H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH (l) △H2=-Q2 kJ/mol
C2H5OH (g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。
②碳(s)在氧气供应不充分时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+ O2(g)
O2(g) CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有
。
CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有
。
22.(16分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 。
(2)B为0.1 mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因: 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(4)D是物质的量浓度相同的醋酸和氢氧化钠混合而成的溶液,溶液中醋酸根离子和钠离子浓度相等,则D溶液呈 性。混合过程中醋酸溶液的体积 氢氧化钠溶液体积(填大于、小于或等于)。
(5)E为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
 AgCl(S) Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp =
1.8×10-10
AgCl(S) Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp =
1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1。
21.(12分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_____热反应,且m+n_____p(填“>”“=”“<”)。
(2)若加入B(保持体系体积不变),则A的转化率_________,B的转化率_________。(填“增大”“减小”或“不变”,下同)
(3)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
20.25℃时,水的电离达到平衡:H2O H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com