
题目列表(包括答案和解析)
4、设NA为阿伏加德罗常数,下列说法正确的是( )
A、1molNH2-中含有电子数为9NA
B、标准状况下,22.4LCO2和CO的混合气体中所含分子数小于NA
C、14gN2和CO的混合气体中所含原子数为NA
D、标准状况下,22.4L辛烷完全燃烧生成的二氧化碳分子数为8NA
3、 化学科学需要借助化学专用语言来描述,下列有关化学用语不正确的是( )
化学科学需要借助化学专用语言来描述,下列有关化学用语不正确的是( )
A、碳-12的原子符号: B、氯化钠的电子式:
B、氯化钠的电子式:

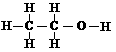
C、乙醇的结构式: D、硫原子结构示意图:
2、材料与化学密切相关,表中材料对应主要化学成分错误的是( )
|
|
材料 |
主要化学成分 |
|
A |
刚玉、金刚石 |
三氧化二铝 |
|
B |
大理石、石灰石 |
碳酸钙 |
|
C |
普通水泥、普通玻璃 |
硅酸盐 |
|
D |
沙子、石英 |
二氧化硅 |
1、广州将于2010年承办第16界亚运会。下列措施有利于节能减排、改善环境质量的有( )
①在大亚湾核电站已安全运行多年的基础上,广东将继续发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题
②积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
③加速建设地铁、轻轨等轨道交通,促进珠三角城市一体化发展,减少汽车尾气排放
④发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
⑤使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
A、③④⑤ B、①②⑤ C、①②④⑤ D、①②③④
19.(12分)
Ⅰ.已知常温下,AgCl的Ksp=1.8×10-10,AgBr的Ksp=4.9×10-13。
(1)现向AgCl的悬浊液中:
①加入AgNO3固体,则c(Cl-) (填“变大”、“变小”或“不变”,下同);
②若改加更多的AgCl固体,则c(Ag+) ;
③若改加更多的KBr固体,则c(Ag+) ,c(Cl-) ;
(2)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是 ;
A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度, Ksp 一定增大
B.两种难溶盐电解质,其中Ksp小的溶解度也一定小
C.难溶盐电解质的Ksp与温度有关
D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变
Ⅱ.最近有人制造了一种燃料电池使汽油氧化直接产生电流,其中一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以辛烷为汽油的代表物,则这个电池放电时必发生反应的化学方程式是 。
(2)这个电池负极的电极反应式为C8H18 + 25O2- -50e-==8CO2 + 9H2O,,正极的电极反应式为 。固体电解质里O2-的移动方向是 ,向外电路释放电子的电极是 。
18.(8分)利用N2和H2可以实现NH3的
工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g )
) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
完成氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
4NH3(g)+5O2(g)==4NO(g)+6H2O(g);△H= kJ/mol
 (2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)
 2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T1和T2的关系是:T1_______T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最低的是________(填字母).
(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算该条件下的平衡常数。(写出计算过程,结果保留小数点后一位)
17.(18分)A和B在一定条件下可合成芳香族化合物E,G在标准状况下是气体,此情况下的密度为1.25g/L。各物质间相互转化关系如下所示:请回答下列问题:
(1)G中的官能团是 (用化学式表示),D中的官能团名称是 ,F的结构简式为 。
(2)指出反应类型:① ,② ,③ 。
(3) 写出化学方程式:A→C ;
C与新制的氢氧化铜悬浊液反应: 。
(4)满足下列条件的B的同分异构体有 种。
①遇FeCl3溶液显紫色 ②能发生银镜反应 ③苯环上只有两个取代基
16. (12分)完成以下实验:①
(12分)完成以下实验:①
用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 _。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 _ 、 (写出两种有机物的结构简式)。
(3)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,上图中采取的措施有 、
_。
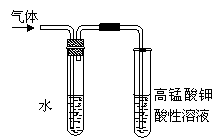 (4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。用下图装置进行实验的目的是 _;下图中右边试管中的现象是 ;水的作用是 。
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。用下图装置进行实验的目的是 _;下图中右边试管中的现象是 ;水的作用是 。
15.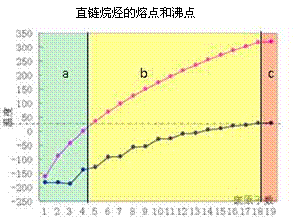 仔细观察右图,下列有关说法正确的是
仔细观察右图,下列有关说法正确的是
A.图中b区的直链烷烃在常温下呈液态
B.直链烷烃的熔点随分子中碳原子的增加
逐渐升高
C.汽油的化学成份为C5-C12的碳氢化
合物,分馏石油时,收集汽油的温度应
控制在200℃以下
D.碳原子数相同的不同烷烃,其沸点都
相同
14.设NA为阿伏加德罗常数,下列叙述中不正确的是
A.1LpH=1的甲酸溶液中,H+ 数目为0.1 NA
B.标准状况下,3.36L乙醇中含有的分子数为0.15 NA
C.1 mol甲基(-CH3)所含电子数9NA
D.1L 1mol/L的FeCl3溶液所含的Fe3+ 数目为NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com