
题目列表(包括答案和解析)
6.人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO ,37 ℃时,该反应的平衡常数K=220 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO ,37 ℃时,该反应的平衡常数K=220 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ( )
( )
A.CO与HbO2反应的平衡常数K=
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
5.25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是 ( )
A.2H+(aq) + (aq)+
(aq)+ (aq)+2OH
(aq)+2OH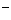 (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H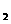 O(1);
O(1); H=
H= 57.3 kJ/mol
57.3 kJ/mol
B.KOH(aq)+ H
H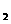 SO4(aq)=
SO4(aq)=  K
K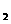 SO4(aq)+H
SO4(aq)+H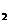 O(I);
O(I);  H=
H= 57.3kJ/mol
57.3kJ/mol
C.C8H18(I)+  O
O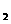 (g)=8CO
(g)=8CO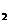 (g)+ 9H
(g)+ 9H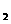 O;
O;
 H=
H= 5518
kJ/mol
5518
kJ/mol
D.2C8H18(g)+25O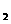 (g)=16CO
(g)=16CO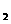 (g)+18H
(g)+18H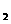 O(1);
O(1);  H=
H= 5518
kJ/mol
5518
kJ/mol
4.物质的量浓度相同的下列溶液,pH由大到小排列正确的是 ( )
A.Ba(OH)2、 Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2SO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、C6H5COOH、C2H5OH、HCl
3.下列说法正确的是 ( )
A.增大压强,活化分子数增加,化学反应速率一定增大
B.升高温度,活化分子百分数增加,化学反应速率一定增大
C.活化分子间所发生的分子间的碰撞为有效碰撞
D.加入反应物,使活化分子百分数增加,化学反应速率增大
2.Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O 。下列说法正确的是 ( )
。下列说法正确的是 ( )
 A.石墨电极上产生氢气
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成。
1.下列措施不能达到节能减排目的的是
A.利用太阳能制氢燃料 B.用家用汽车代替公交车
C.利用潮汐能发电 D.用节能灯代替白炽灯
19.(共计12分)
A.锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)葡萄糖酸锌[CH2OH(CHOH4COO)2Zn是目前市场上流行的补锌剂。写出Zn2+基
态电子排布式 ;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式是 。
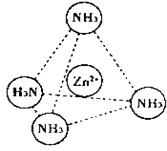
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子空间构型为 ;
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中
表示[Zn(NH3)4]2+中Zn2+与N之间的化学键 。
(3)下图表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;

该化合物的晶体熔点比干冰高得多,原因是 。
18.(10分)下图是工业生产硝酸铵的流程。
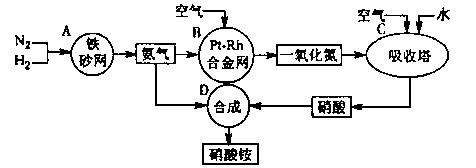
(1)吸收塔C中通入空气的目的是 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=一1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g)  2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 。
16.(12分);图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:

(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用 隔开。
(2) Z→L反应的名称是 ,K的电子式为 。
(3) 写出B→F的离子方程式 。
(4) 写出K与CO2反应的化学方程式 。
(5) Y与NaClO和B混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出有关反应的离子方程式 。
17(10分).阿明洛芬属于苯甲酸类抗炎药,其镇痛效果优于布洛芬。下图是阿明洛芬的一条合成线
路。
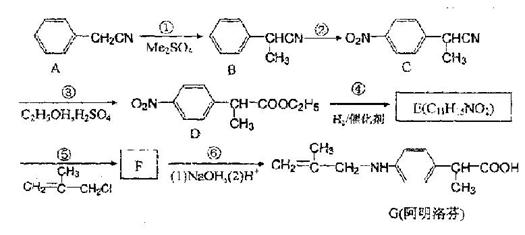
(1)写出下列反应类型:① ,④ 。
(2)写出下列物质的结构简式
E: F:
(3)反应③可以看成是两步反应的总反应,第一步是-CN的完全水解反应形成-COOH,
请写出第二步反应的方程式。
(4)在上述反应步骤中涉及到的有机物A~G中没有手性碳原子的是 (填化合物
 的序号)
的序号)
(5)化合物E的满足下列要求的同分异构体共有 个。(1含有基团 ,
2含有对位二取代苯环)
(6)为了促使反应进行,反应⑤要在 条件下进行。(填“酸性”或“碱性”)
13.(10分)江苏省拥有很长的海岸线,具有丰富的海洋资源,因此盐化工是本省的一个重要产业。从盐卤初步得到的光卤石(KCl·MgCl2·6H2O)晶体中,还含有约8%的NaCl。
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
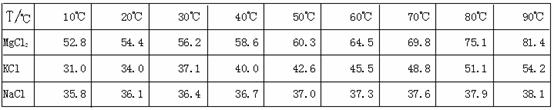
 并设计出下面的实验流程:
并设计出下面的实验流程:
根据他们提供的数据和实验回答下列问题:
问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用
的方法进一步提纯。操作步骤①中趁热过滤的原因是:
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2·6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别
是 (填写仪器的符号),需要加热的仪器是 (同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。

14(12分).随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:

a.6CO2+6H2O C6H12O6+6O2 b .CO2+3H2 CH3OH+H2O


c.CO2+CH4 CH3COOH d. 2CO2+6H2 CH2==CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
 CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
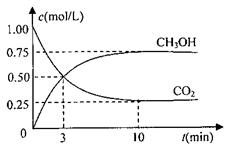 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(4)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
 N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。

图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将3amolH2和amolN2放入带有活塞的密闭容器中,如果活塞能自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为 。
15(12分).KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2)为原料,通过
液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再
用镍板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
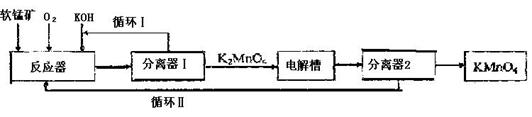
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、
Si的氧化物含量较高,会导致KOH消耗量偏高,用方程式表示KOH消耗偏高的原因
、 。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极: ;阳极: 。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为 。与该传统工
艺相比,电解法的优势是 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com