
题目列表(包括答案和解析)
17.在水电离出来的氢离子浓度为10-13mol/L的溶液中,下列各组离子一定不能大量存在的是
A. Na+、NO3-、Al3+、K+ B. Na+、ClO3-、ClO-、ClO4-
C. K+、Cr2O72-、I-、Na+ D. Na+、S2O32-、SO42-、NH4+
16.向体积为Va的0.05mol/L CH3COOH溶液中加入体积为Vb的0.05mol/LKOH溶液,下列关系错误的是:
A. Va>Vb时:C(CH3COOH)+ C(CH3COO-)>C(K+)
B. Va=Vb时:C(CH3COOH)+ C(H+)== C(OH-)
C. Va<Vb时:C(CH3COO-)>C(K+)>C(OH-)>C(H+)
D. Va与Vb任意比时:C(K+)+C(H+)==C(OH-)+C(CH3COO-)
15.已知复分解反应:2 CH3COOH+Na2CO3==2CH3COONa+ H2O+CO2↑可自发进行。在常温下,测得浓度均为0.1mol/L的下列六种溶液的PH:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
|
PH值 |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
表中数据提示出复分解反应的一条规律,即碱性较强的物质发生类似反应可生成碱性较弱的物质。依据该规律,请你判断下列反应不能成立的是:
A.CO2 +H2O+ NaClO== NaHCO3+HClO B.CO2 +H2O+ 2NaClO== Na2CO3+2HClO
C.CH3COOH+ NaCN== CH3COONa+HCN D.CH3COOH+ NaClO== CH3COONa+ HClO
14.常温下,下列关于pH值的说法正确的是
A.在pH=12的溶液中,由水提供的c(OH-)一定是10-12mol/L。
B.把pH=2与pH=12的酸、碱溶液等体积混合后,所得溶液的pH值为7
C.pH=6与pH=4的两盐酸等体和混合后,所得溶液中c(H+)最接近0.5×(10-8+
10-10)mol/L
D.在稀氨水里加入NH4Cl晶体后,pH值会降低,若再向此溶液中加入少量稀盐酸或少量氢氧化钠溶液后,溶液的pH值都几乎不变
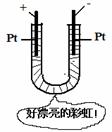
13.如右图所示,在U形管中装入滴有紫色石蕊试液且混合均匀的某溶液,通直流电,一段时间后U形管中会形成一个倒立的漂亮的“彩虹”,则U形管中的溶液可能为:
A.H2SO4溶液 B.NaOH溶液 C.AgNO3溶液 D.Na2SO4溶液
12.往含有S2-和Cl-的稀溶液中逐滴加入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(S2-)/c(Cl-)的比值为:
 A .2V1/V2 B.2(V2-V1)/V1
C.2V2/V1 D.V1/2(V2-V1)
A .2V1/V2 B.2(V2-V1)/V1
C.2V2/V1 D.V1/2(V2-V1)
11.已知在一密闭绝热容器中,饱和石灰水中存在平衡:Ca(OH)2(s)
 Ca2+(aq)+2OH-(aq),现向其中加入少量CaO粉末,则下列说法错误的是:
Ca2+(aq)+2OH-(aq),现向其中加入少量CaO粉末,则下列说法错误的是:
 A.析出固体的质量增加 B .溶液的pH值不变
A.析出固体的质量增加 B .溶液的pH值不变
C.溶液中的OH-数目减少 D.溶液中的Ca2+浓度减小
10.关于铅蓄电池的说法正确的是:
A. 充电时外接电源的正极与铅蓄电池的正极相联,电极上发生还原反应。
B. 放电时,正极上发生的电极反应式为:Pb(s)+SO42-(aq)==PbSO4(s)+2e-
C. 放电过程中,正极附近溶液的PH增大。
D. 充电时,阳极发生的电极反应式为:PbSO4(s)+2e- == Pb(s)+SO42-(aq)
9.欲使0.1mol/L的稀氨水中,C(NH3·H2O)/C(OH-)逐渐减小,可采取的措施是:
A.加入少量Al(OH)3固体 B.加入少量NaOH晶体
C.加入少量NH4Cl晶体 D.继续加0.1mol/L的稀氨水
8.已知重铬酸钾(K2Cr2O7)是一种中学化学常用的强氧化剂,重铬酸钾溶液中存在如下平衡:
H+(aq)+
CrO42-(aq)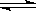 Cr2O72-(aq)+H2O 。若要使溶液的橙色加深,下列可采用的方法是:
Cr2O72-(aq)+H2O 。若要使溶液的橙色加深,下列可采用的方法是:
A.加入适量稀盐酸 B.加入适量稀硝酸 C.加入适量烧碱固体 D.加水稀释
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com