
题目列表(包括答案和解析)
44、FeS饱和溶液中c(Fe2+)·c(S2-)=Ksp,常温下Ksp(FeS)=8.1×10-17。理论上FeS的溶解度为
g,而事实上其溶解度远大于这个数值,其原因可能是
。
43、在氯化铁溶液中存在下列平衡:FeCl3+3H2O Fe(OH)3+3HCl ΔH >0
Fe(OH)3+3HCl ΔH >0
 (1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体。向这种液体中加
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体。向这种液体中加
入MgCl2溶液,产生的现象为 。
(2)不断加热FeCl3溶液时,蒸干其水分并灼烧得到的固体可能是 。
(3)在配制FeCl3溶液时,为防止浑浊,应加入 。
42、常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中由水电离出的c(H+) HCl溶液中由水电离出的c(H+)。(填“>”、“<”
或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)= mol/L;
c(H+)-c(MOH)= mol/L。
(2)常温下若将0.2 mol/L MOH溶液与0.1 mol/L HCl溶液等体积混合,测得混合溶液的pH<7,
则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则
混合溶液的pH 。(填“>7”、“<7”或“无法确定”)
41、(1)现有pH=2的HCl溶液100 mL,要使它的pH=3,如果加入蒸馏水,需加水 mL;如果加入pH=4的HCl溶液,需加入此HCl溶液 mL(假定溶液体积有加和性,下同)。
(2)将pH=8的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH= 。
(3)将0.1 mol/L盐酸和0.06 mol/L氢氧化钡溶液等体积混合后,该混合溶液的pH= 。
 (4)25℃时,pH=a的10体积的某强酸与pH=b的1体积的某强碱混合后,溶液呈中性,则a和b
(4)25℃时,pH=a的10体积的某强酸与pH=b的1体积的某强碱混合后,溶液呈中性,则a和b
满足的关系 。
40、某温度(t℃)时,水的离子积为KW=1×10-13,则该温度(填“大于”、“小于”或“等于”)
25℃,其理由是 。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b= 。
(2)若所得混合液的pH=2,则a∶b= 。此溶液中各种离子的浓度由大到小排列顺序
是 。
39、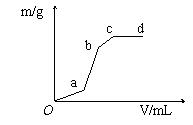 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,根据下图曲线推测
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,根据下图曲线推测
oa段产生的沉淀为 ,
ab产生段的沉淀为 ,
bc段产生的沉淀为 ,
38、 NaHCO3溶液中(1)按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)
。
(2)c(Na+)=_______________,c(Na+)+c(H+)=_______________ 。
37、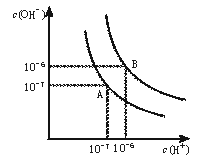 水的电离平衡曲线如下图所示。
水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为 。
36、从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
|
溶度积 |
2.8×10-9 |
6.8×10-6 |
5.5×10-6 |
1.8×10-11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为 (填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是 ;如果不能直接投入,应将贝壳作何处理,试写出化学方程式 。
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为
(填“可以”或“不可以”)得到Mg(OH)2。在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他 (填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是 。(用离子方程式表示)
(3)已知海水中镁离子浓度为1.8×10-3mol/L,则要使镁离子产生沉淀,溶液的PH最低应为 。
35、某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
 A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2-3滴酚酞
A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2-3滴酚酞
B.用标准溶液润洗滴定管2-3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1-2cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写) ;
(2)上述B步骤操作的目的是 ;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是 ;
(4)判断到达滴定终点的实验现象是 ;
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结
果产生的影响是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com