
题目列表(包括答案和解析)
15.下列离子方程式中正确的是( )
A.向Ba(OH)2溶液逐滴加入NH4HSO4溶液至刚好沉淀完全: Ba2++OH-+H++SO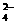 =BaSO4↓+H2O
=BaSO4↓+H2O
B.用Pt电极电解MgCl2溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.碳酸氢钠溶液与硫酸溶液反应:HCO +H+=CO2↑+H2O
+H+=CO2↑+H2O
D.将少量氨水滴入硝酸银溶液中:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
14.在一定温度下,反应1/2H2(g)+1/2X2(g) HX(g)的平衡常数为9。若将2.0 mol
HX(g)的平衡常数为9。若将2.0 mol
的HX(g)通入体积为2.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A. 9% B.18% C.30% D.80%
13.向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时,都会引起 ( )
A.溶液的pH增大 B.CH3COOH的电离程度增大
C.溶液的导电能力减小 D.溶液的c (OH – )减小
12.常温下,某溶液中由水电离的c(H+)=1×10-13 mol·L-1,该溶液可能是( )
①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
11、在t℃下,某反应达到平衡,平衡常数K=c(NO)c(SO3)/c(NO2)c(SO2)。恒容时,温度升高,NO浓度减小。下列说法正确的是( )
A、 该反应的焓变为正值 B、恒温下增大压强,反应体系的颜色加深
C、 升高温度,逆反应速率减小 D、该反应化学方程式为NO+SO3  NO2+SO2
NO2+SO2
10、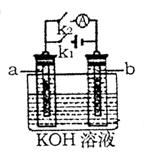 如右图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1 一段时间,观察到两只玻璃管内部都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是 ( )
如右图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1 一段时间,观察到两只玻璃管内部都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是 ( )
A、断开K2,闭合K1一段时间,溶液的PH要变大
B、断开K1,闭合K2时,b极上电极反应式为:2H++2e―=H2↑
C、断开K2,闭合K1时,a极上的电极反应式为:
4OH―-4e―=O2↑+2H2O
D、断开K1,闭合K2时,OH―向b极移动
9.根据下列事实,判断离子的氧化性顺序为 ( )
①A+B2+=A2++B ②D+2H2O=D(OH)2+H2↑
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-→E,B→B2+ +2e-
A.D2+>A2+>B2+>E2+ B.D2+>E2+>A2+>B2+ C.E2+>B2+>A2+>D2+ D.A2+>B2+>D2+>E2+
8.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
7.在25℃、101kPa下,1g乙醇完全燃烧生成CO2和液态水时放热29.72kJ,下列热化学方
程式正确的是( )
A.CH3CH2OH(l)+3O2(g)=2CO2(g)+ 3H2O(l);△H=+1367kJ/mol
B.2CH3CH2OH(l)+6O2(g)=4CO2(g)+ 6H2O(l);△H=-2734kJ/mol
C.2CH3CH2OH(l)+6O2(g)=4CO2(g)+ 6H2O(l);△H=-1367kJ/mol
D.2CH3CH2OH(l)+6O2(g)=4CO2(g)+ 6H2O(l);△H=+2734kJ/mol
6.向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中各离子数目也相应地发生变化。溶液中各离子数目与图中四条曲线的对应关系完全正确的是( )
|
|
 |
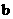 |
 |
 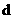 |
|
A |
 |
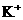 |
 |
 [来源:] [来源:] |
|
B |
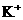 |
 |
 |
 |
|
C |
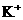 |
 |
 |
 |
|
D |
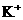 |
 |
 |
 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com