
题目列表(包括答案和解析)
20. 现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO3-、SO42-、CO32-。现将它们分别配成0.1 mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中篇加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是
;
(2)E溶液是 ,判断依据是
;
(3)写出下列四种化合物的化学式:A 、C 、
D 、F 。
19. 右图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
 (1)A、B、C、D代表的物质分别为
、
、
、
(填化学式);
(1)A、B、C、D代表的物质分别为
、
、
、
(填化学式);
(2)反应①中的C、D均过量,反应的离子方程式分别是
(3)反应②中,若B与F物质的量之比为4:3,G、H分别是 、 (填化学式);
(4)反应③产物中K的化学式为 ;
(5)反应④的离子方程式为 。
18. 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题:
(1)T的原子结构示意图为 .
(2)元素的非金属性(原子的得电子能力):Q_____W(填“强于”或“弱于”)。
 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
.
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
.
(4)原子序数比R多l的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 .
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
17. (1)下面a-e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
①其中标示出仪器使用温度的是___________(填写编号);
②能够用以精确量取液体体积的是________(填写编号);
③由于错误操作,使得到的数据比正确数据偏小的是______(填写编号);
A.用量筒量取一定量液体时,俯视液面读数
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容后,所得溶液的浓度
④称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为________g.
(2)用托盘天平和小烧杯称量一角匙NaOH的质量,正确的操作顺序为 (填序号,可重复)
A. 调整零点,使指针静止时处于标尺中间
B.将游码拨到刻度尺的零处
C.取NaOH放入烧杯中称量
D.称量小烧杯的质量
E.将砝码放回砝码盒内
F. 记录称量结果
16. 含有amol FeBr2的溶液中,通入xmol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A. x=0.4a, 2Fe2++Cl2==2Fe3++2Cl-
B. x=0.6a, 2Br-+Cl2==Br2+2Cl-
C. x=a, 2Fe2++2Br-+2Cl2==Br2+2Fe3++4Cl-
D. x=1.5a, 2Fe2++4Br-+3Cl2==2Br2+2Fe3++6Cl-
15. 下列离子方程式与所述事实相符且正确的是( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O==HClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气,MnO2+2H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C. 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-
D. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3==2FeO42-+3Cl-+H2O+4H+
14. 元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C. 同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
13.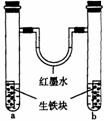 右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是 ( )
右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是 ( )
A. 红墨水柱两边的液面变为左低右高
B. 生铁块中的碳是原电池的正极
C. 两试管中相同的电极反应式是:Fe-2e-=Fe2+
D. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
12. 下列有关物质检验的实验结论正确的是( )
|
选项 |
实验操作及现象 |
实验结论 |
|
A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
|
B |
向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
|
C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
|
D |
将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 |
该物质一定属于醛类 |
11. NA代表阿伏加德罗常数。下列的关叙述正确的是( )
A. 标准状况下,2.24L H2O含有的分子数等于0.1NA
B. 3.4g NH3中含N-H键数目为0.2NA
C. 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28 g
D. 常温下,100mL 1mol/L Na2CO3溶液中阴离子总数大于0.1NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com